
(10分) 回答下列问题
(1)写出过氧化钙与纯碱溶液反应的化学方程式:_______________________________________________;
(2)据报道,在全国各地发生了多起将84消毒液与洁厕灵混合使用,导致氯气中毒的事件,写出该反应的离子反应方程式:_____________________________________________________________________;
(3)汞与次氯酸等物质的量发生反应,生成水和另一含汞产物,含汞产物的名称为_______________。
(4)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:S2O82-+2I-=2SO42-+I2。已知Fe3+氧化性比S2O82-氧化性弱,Fe2+的还原性比I-还原性弱,实验却表明Fe3+、Fe2+可催化上述反应。简述Fe3+能加快该反应速率起催化作用的原因:________________________________________________________________________________。
(5)有机分子中,四价的碳原子以一个、二个、三个或四个单键分别连接一个、二个、三个或四个其它碳原子时,被分别称为伯、仲、叔或季碳原子(也可以分别称为第一、第二、第三或第四碳原子),例如2,2,4-三甲基戊烷中有5个伯碳原子,仲、叔、季碳原子各1个。由6个叔碳原子和6个伯碳原子(其余为氢原子)构成的饱和烃有 种(不考虑顺反异构和光学异构)。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
 a
a查看答案和解析>>
科目:高中化学 来源: 题型:

图2-10
试回答下列问题:
(1)粗盐中含有Ca2+、Mg2+、![]() 等杂质,精制时所用试剂为:A.盐酸;B.BaCl2溶液;C.NaOH溶液;D.Na2CO3溶液。加入试剂的顺序是:_______________________________________。
等杂质,精制时所用试剂为:A.盐酸;B.BaCl2溶液;C.NaOH溶液;D.Na2CO3溶液。加入试剂的顺序是:_______________________________________。
(2)电解饱和食盐水时,与电源正极相连的电极上发生的反应为_____________________。与电源负极相连的电极附近溶液pH__________(填“变大、不变”或“变小”)。若1 mol电子的电量为96
(3)由MgCl2·6H2O晶体脱水制无水MgCl2时,MgCl2·6H2O晶体在_________气氛中加热脱水,该气体的作用是_____________________________。
(4)电解无水MgCl2所得的镁蒸气可以在下列____________气体中冷却。
A.H2 B.N
查看答案和解析>>
科目:高中化学 来源:2010-2011学年江苏省高三上学期期中考试化学卷 题型:填空题
10分)下列转化关系图中,A、B、C、D、E常温下为气体,B、E、F、K为单质,其中F为黑色固体;C、D均能使澄清的石灰水变混浊,D、E均能使品红溶液褪色;I是一种红棕色固体氧化物。
请回答下列问题:
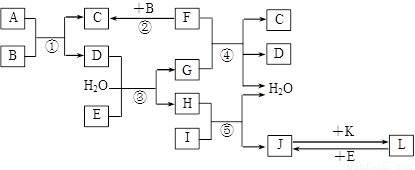
(1)C的电子式为 。
(2)检验溶液L中金属阳离子的方法是 。
(3)反应③的离子方程式为 。
(4)F与G的浓溶液反应的化学方程式为 。
(5)气体A的密度为2.68g·L-1(标准状况),通过计算、推理,可确定A的分子式为 。
查看答案和解析>>
科目:高中化学 来源:2013届河北省高一下学期第一次月考化学试卷 题型:填空题
(10分)按下列要求回答:现有①BaCl2;②金刚石;③NH4Cl;④Na2SO4;⑤干冰;⑥碘
(1)熔化时不需要破坏化学键的是__________(填序号,下同),熔点最低的是__________。
(2)属于离子化合物的是__________
(3)①的电子式是________________,⑤的电子式是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com