

| 实验目的 | 操作 | 实验现象 | 结论 |
| 1检验Cl- | 取少许滤液于试管中,加入硝酸酸化的硝酸银溶液 | 有白色沉淀产生 | 含有Cl- |
| 2检验NH4+ | 取少许滤液于试管中,加入浓氢氧化钠溶液并加热,将润湿的红色石蕊试纸置于试管口附近 | 石蕊试纸变蓝色 | 含有NH4+ |
分析 (1)玻璃棒的作用是使液体缓缓流入漏斗,灼烧固体在坩埚中进行.
(2)根据固体的颜色和化学性质分析该物质.
(3)能使双氧水迅速产生氧气的黑色物质是二氧化锰.
(4)氯离子的检验是用硝酸酸化的硝酸银溶液,若产生白色沉淀,就证明含有氯离子;
铵根离子的检验是用浓氢氧化钠溶液并加热,然后用湿润的红色石蕊试纸检验,氨气能使湿润的红色石蕊试纸变蓝色.
解答 解:(1)过滤操作中,玻璃棒的作用是引流,灼烧固体在坩埚中进行,所以操作③灼烧滤渣时要用到坩埚,
故答案为:引流;坩埚;
(2)使澄清石灰水变浑浊的气体有二氧化碳和二氧化硫,二氧化碳可由黑色的碳单质灼烧制得,二氧化硫可由淡黄色的硫单质灼烧制得,所以该黑色物质是碳单质.
故答案为:C;
(3)能使带火星的木条复燃的气体是氧气,能使双氧水迅速产生氧气的黑色固体物质是二氧化锰;
故答案为:MnO2;
(4)氯离子的检验:取少许滤液于试管中,加入硝酸酸化的硝酸银溶液,银离子和氯离子反应生成不溶于水的白色沉淀氯化银;如果有白色沉淀生成,就说明有氯离子,铵根离子的检验:铵根离子能和强碱在加热条件下反应生成氨气,氨气能使湿润的红色石蕊试纸变蓝色;如果湿润的红色石蕊试纸变蓝色,就说明有铵根离子存在,
故答案为:
| 实验目的 | 操作 | 实验现象 | 结论 |
| 1、检验Cl- | 取少许滤液于试管中,加入硝酸酸化的硝酸银溶液 | 有白色沉淀产生 | 含有Cl- |
| 2、检验NH4+ | 取少许滤液于试管中,加入浓氢氧化钠溶液并加热,将润湿的红色石蕊试纸置于试管口附近 | 石蕊试纸变蓝色 | 含有NH4+ |
点评 本题考查了基本实验操作及离子的检验,难度不大,熟悉中学阶段常见阴阳离子的检验方法,如氯离子、硫酸根离子、钠离子、钾离子、铵根离子等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 1.2mL,NO | B. | 2.4mL,O2 | C. | 3.5mL O2 | D. | 4mL,NO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
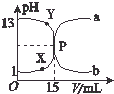 如图曲线a和b是盐酸与氧氧化钠溶液在常温下的相互滴定的滴定曲线,下列叙述中正确的是( )
如图曲线a和b是盐酸与氧氧化钠溶液在常温下的相互滴定的滴定曲线,下列叙述中正确的是( )| A. | 盐酸的物质的量浓度为1 mol•L-1 | |
| B. | P点时反应恰好完成,溶液呈中性,但它不是滴定终点 | |
| C. | X点时c(Cl-)>c(H+)>c(Na+)>c(OH-) | |
| D. | Y点时溶液呈碱性,溶液中c(H+)•c(OH-)>1×10-14 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铊是易导电的银白色金属 | B. | 能生成+3价离子 | ||
| C. | 氢氧化铊是两性氢氧化物 | D. | Tl3+的氧化能力比Al3+弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子学说 | B. | 分子学说 | C. | 等电子体学说 | D. | 元素周期律 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol CO2中含有原子数NA | |
| B. | 1mol/L的硫酸钠溶液中,所含Na+数为2NA | |
| C. | 标准状况下,11.2 L水所含分子数为0.5 NA | |
| D. | 1 mol Fe和足量盐酸完全反应失去的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaF=NaCN | B. | NaF>NaCN | C. | NaF<NaCN | D. | 无法确定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com