
【题目】现有前四周期的5种元素的部分信息如下表所示:
元素代号 | 元素部分信息 |
X | X的阴离子核外电子云均呈球形 |
Y | 原子的最高能级上有3个未成对电子,其最简单气态氢化物在水中的溶解度在同族元素所形成的最简单气态氢化物中最大 |
Z | 基态原子核外有3个能级填充了电子,能量最高能级的电子数等于前两个能级的电子数之和 |
R | 元素原子的最外层电子排布式为nsn-1npn-1 |
T | 一种核素的质量数为65,中子数为36 |
根据上述元素信息,回答下列问题。
(1)基态T2+的电子排布式为__。
(2)Y、Z、R的电负性由大到小的顺序为__(用元素符号表示)。
(3)YX4+的空间构型为__,离子中![]() 原子的杂化轨道类型为___,YX4+的电子式为__。
原子的杂化轨道类型为___,YX4+的电子式为__。
(4)YX3的一种等电子体分子是__,YX3的键角大于X2Z的键角的主要原因是__。
【答案】1s22s22p63s23p63d9或[Ar]3d9 O>N>Si 正四面体形 sp3杂化 ![]() PH3 NH3、H2O分子中N、O的孤电子对数分別是1、2,孤电子对数越多,对成键电子对的排斥力越强,键角越小
PH3 NH3、H2O分子中N、O的孤电子对数分別是1、2,孤电子对数越多,对成键电子对的排斥力越强,键角越小
【解析】
X的阴离子核外电子云均呈球形,则X为H元素;Y原子的能级上有3个未成对电子,其最简单气态氢化物在水中的溶解度在同族元素所形成的最简单气态氢化物中最大,则Y为N元素;Z基态原子核外有3个能级填充了电子,能量最高能级的电子数等于前两个能级的电子数之和,则Z为O元素;R元素原子的最外层电子排布式为nsn-1npn-1,s能级上最多排列2个电子,则n=3,所以R为Si元素;T一种核素的质量数为65,中子数为36,其质子数=65-36=29,为Cu元素;据此分析解答。
通过以上分析知,X、Y、Z、R、T分别是H、N、O、Si、Cu元素。
(1)Cu失去2个电子生成Cu2+,根据构造原理,基态铜离子核外电子排布式为1s22s22p63s23p63d9(或[Ar]3d9),故答案为:1s22s22p63s23p63d9(或[Ar]3d9);
(2)元素的非金属性越强,电负性越大,Y、Z、R分别是N、O、Si元素,非金属性O>N>Si,则电负性O>N>Si,故答案为:O>N>Si;
(3)NH4+中N原子价层电子对个数是4且不含孤电子对,根据价层电子对互斥理论判断该离子空间构型为正四面体结构,N原子杂化类型为sp3,NH4+中N原子和每个H原子形成一个共价键,其电子式为![]() ,故答案为:正四面体;sp3;
,故答案为:正四面体;sp3;![]() ;
;
(4)NH3的一种等电子体分子中含有4个原子且价电子数是8,其等电子体为PH3(或AsH3等),NH3、H2O分子中N、O的孤电子对数分別是1、2,孤电子对数越多,对成键电子对的排斥力越强,键角越小,故答案为:PH3(或AsH3等);NH3、H2O分子中N、O的孤电子对数分別是1、2,孤电子对数越多,对成键电子对的排斥力越强,键角越小。


科目:高中化学 来源: 题型:
【题目】向含有Na2CO3、NaAlO2的混合溶液中逐滴加入150 mL 1 mol L-1的HC1溶液,测得溶液中某几种离子的物质的量的变化情况如图所示。下列说法不正确的是
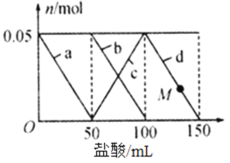
A.b和c曲线表示的离子反应均为CO32-+H+= HCO3-
B.结合H+的能力:AlO2>CO32> HCO3>Al(OH)3
C.原混合溶液中,CO32与AlO2的物质的量之比为2∶1
D.M点时A1(OH)3的质量等于3.9 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】北京大学和中国科学院的化学工作者合作,已成功研制出碱金属与C60形成的石墨夹层离子化合物。将石墨置于熔融的钾或气态的钾中,石墨吸收钾而形成称为钾石墨的物质,其组成可以是C8K、C12K、C24K、C36K、C48K、C60K等等。在钾石墨中,钾原子把价电子交给石墨层,但在遇到与金属钾易反应的其他物质时还会收回。下列分析中正确的是( )
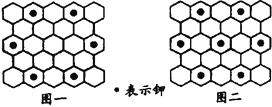
A. 题干中所举出的6种钾石墨,属于同素异形体
B. 若某钾石墨的原于分布如图一所示,则它所表示的是C24K
C. 若某钾石墨的原子分布如图二所示,则它所表示的是C12K
D. 另有一种灰色的钾石墨C32K,其中K的分布也类似图中的中心六边形,则最近两个K原子之间的距离为石墨键长的4![]() 倍
倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.NH3中氮原子的杂化方式为sp3杂化
B.[Cu(NH3)4]2+中,NH3是配体
C.NH4+、PH4+、CH4、BH4-互为等电子体
D.NH3的沸点比PH3的沸点低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氮、氧、氟、硫是中学常见的非金属元素,铁离子可与由这几种元素组成的SCN-、CN-、F-等形成很多配合物。
(1)基态Fe原子中,电子占据的最高电子层符号为__,该电子层具有的原子轨道数为__。
(2)已知(CN)2是直线形分子,并有对称性,则(CN)2中π键和σ键的个数比为__;在配合物[Fe(SCN)]2+中,提供空轨道接受孤对电子的微粒是__。
(3)配合物K4[Fe(CN)6]中不存在的作用力是__(填序号)。
A.极性键 B.离子键 C.非极性键 D.配位键
(4)写出一种与SCN-互为等电子体的分子__(用化学式表示),该分子的空间构型为__。
(5)已知乙烯酮(CH2=C=O)是一种重要的有机中间体,可由CH3COOH在(C2H5O)3P=O存在下加热脱H2O得到。乙烯酮分子中碳原子的杂化轨道类型是__。1mol(C2H5O)3P=O分子中含有的σ键的物质的量为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某无机化合物的二聚分子结构示意图,该分子中A、B两种元素都是第3周期的元素,分子中所有原子的最外层都达到8个电子的稳定结构。下列说法不正确的是( )
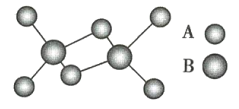
A.该物质的化学式是Al2Cl6B.该物质是离子化合物,在熔融状态下能导电
C.该物质在固态时所形成的晶体是分子晶体D.该物质中不存在离子键,也不含有非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】β-氮化碳的硬度超过金刚石晶体,成为首屈一指的超硬新材料,已知该氮化碳的二维晶体结构如图所示。下列说法不正确的是( )
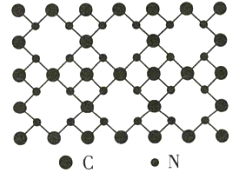
A.该晶体中的碳、氮原子都满足8电子稳定结构
B.该晶体中碳显+4价,氮显-3价
C.该晶体中每个碳原子与四个氮原子相连,每个氮原子与三个碳原子相连
D.该晶体的分子式为C3N4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼及其化合物的应用广泛。试回答下列问题:
(1)基态![]() 原子的价电子轨道表示式为__________,其第一电离能比
原子的价电子轨道表示式为__________,其第一电离能比![]() 的__________(填“大”或“小”)。
的__________(填“大”或“小”)。
(2)氨硼烷(![]() )被认为是最具潜力的新型储氢材料之一,分子中存在配位键,提供孤电子对的原子是__________,写出一种与氨硼烷互为等电子体的有机小分子:___________________(填化学式)。
)被认为是最具潜力的新型储氢材料之一,分子中存在配位键,提供孤电子对的原子是__________,写出一种与氨硼烷互为等电子体的有机小分子:___________________(填化学式)。
(3)常温常压下硼酸(![]() )的晶体结构为层状,其二维平面结构如图所示。
)的晶体结构为层状,其二维平面结构如图所示。
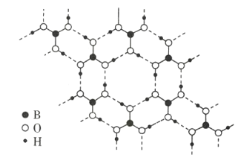
①B原子的杂化方式为__________。从氢键的角度解释硼酸在冷水中的溶解度小而加热时溶解度增大: _________________。
②路易斯酸碱理论认为,任何可接受电子对的分子或离子叫路易斯酸,任何可给出电子对的分子或离子叫路易斯碱。从结构角度分析硼酸是路易斯酸:______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化镓(GaN)是第三代半导体材料,具有热导率高、化学稳定性好等性质,在光电领域和高频微波器件应用等方面有广阔的前景。
(1)传统的氮化镓制各方法是采用GaC13与NH3在一定条件下反应。NH3的电子式为___。
(2)Johnson等人首次在1100℃下用液态镓与氨气制得氮化镓固体,该可逆反应每生成1 mol H2放出10.3 kJ热量。其热化学方程式为_________。
(3)在恒容密闭容器中,加入一定量的液态镓与氨气发生上述反应,测得反应平衡体系中NH3的体积分数与压强(p)、温度(T)的关系如图所示。
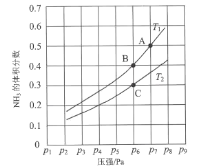
①下列说法正确的是___(填标号)。
a. 温度:T1>T2
b. 当百分含量ω(NH3)=ω(H2)时,说明该反应处于化学平衡状态
c. A点的反应速率小于C点的反应速率
d. 温度恒定为T2,达平衡后再充入氦气(氦气不参与反应),NH3的转化率不变
②既能提高反应速率又能使平衡正向移动的措施有___(写出一条即可)。
③气体分压(p分)=气体总压(p总)×体积分数,用平衡分压代替物质的量浓度也可以表示平衡常数(记作Kp)。在T2时,用含p6的计算式表示C点的______。
(4)如图可表示氮化镓与铜组装成的人工光合系统的工作原理。H+向______(填“左”或“右”)池移动;铜电极上发生反应的电极反应式为_______。
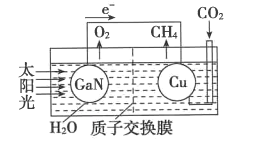
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com