
下列说法正确的是
A. 铅蓄电池放电一段时间后,负极质量减小,正极质量增加
B. 298K时,2H2S(g)+SO2(g)=3S(s)+2H2O(l)能自发进行,则其ΔH<0
C. pH=3的盐酸与pH=11的某碱溶液等体积混合,溶液呈碱性,说明该碱为强碱
D. 标准状况下,22.4L甘油中含有3mol羟基(—OH)
科目:高中化学 来源:2017届福建省晋江市等四校高三第二次联合考试理综化学试卷(解析版) 题型:简答题
[化学—选修3:物质结构与性质]
硫化锌(ZnS)晶体用作分析试剂、荧光体、光导体材,久置湿空气中易被氧化为ZnSO4。回答下列问题:
⑴写出基态Zn原子的价电子排布式__________,基态S原子核外未成对电子数为_____。
⑵ZnSO4中三种元素的电负性由大到小的顺序为_____________________,SO42-的立体构型为________________,其中S的杂化轨道类型为_________。
⑶硫酸锌溶于氨水可生成[Zn(NH3)4]SO4溶液,[Zn(NH3)4]SO4溶液中不存在的微粒间作用力有___________。
a.离子键 b.共价键 c.配位键 d.范德华力 e.氢键
⑷根据下列锌卤化物的熔点和溶解性,判断ZnF2晶体的类型为___________;分析ZnCl2、ZnBr2、ZnI2熔点依次增大的原因________________。
ZnF2 | ZnCl2 | ZnBr2 | ZnI2 | |
熔点/℃ | 872 | 275 | 394 | 446 |
在乙醇、乙醚中溶解性 | 不溶 | 溶解 | 溶解 | 溶解 |
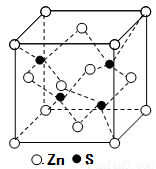
⑸立方ZnS晶体的密度为ρg·cm-3,其晶胞结构如图。S2-周围等距离且最近的Zn2+、S2-依次为______、______;ZnS晶胞中的晶胞参数a=________nm(列出计算式)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省揭阳市高二下学期第一次月考理科综合化学试卷(解析版) 题型:选择题
下图是几种常见有机物之间的转化关系,有关说法正确的是( )

A. 有机物a只能是淀粉
B. 反应①、②、③均为取代反应
C. 有机物c可以使酸性高锰酸钾溶液褪色
D. 有机物d的羧酸类同分异构体只有1种
查看答案和解析>>
科目:高中化学 来源:2017届江苏省、溧水高级中学)等六校高三2月联考化学试卷(解析版) 题型:填空题
甲酸钙广泛用于食品、化工、石油等工业生产上,300~400℃左右分解。
Ⅰ、实验室制取的方法之一是:Ca(OH)2 +2HCHO + H2O2 = Ca(HCOO)2 + 2H2O + H2↑。实验室制取时,将工业用氢氧化钙和甲醛依次加入到质量分数为30-70%的过氧化氢溶液中(投料物质的量之比依次为1∶2∶1.2),最终可得到质量分数98%以上且重金属含量极低的优质产品。
(1)过氧化氢比理论用量稍多,其目的是__________。
(2)反应温度最好控制在30-70℃之间,温度不易过高,其主要原因是__________。
(3)制备时在混合溶液中要加入微量硼酸钠抑制甲醛发生副反应外,还要加入少量的Na2S溶液,加硫化钠的目的是__________。
(4)实验时需强力搅拌45min,其目的是__________;结束后需调节溶液的pH 7~8,其目的是__________。最后经结晶分离、干燥得产品。
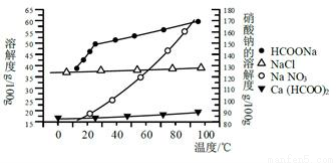
Ⅱ、某研究性学习小组用工业碳酸钙(主要成分为CaCO3;杂质为:Al2O3、FeCO3) 为原料,先制备无机钙盐,再与甲酸钠溶液混合制取甲酸钙。结合如图几种物质的溶解度曲线及表中相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算),现提供的试剂有:A.甲酸钠,B.5mol·L-1硝酸,c.5mol·L-1盐酸,d.5mol·L-1硫酸,e.3%H2O2溶液,f.澄清石灰水。
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe3+ | 1.1 | 3.2 |
Al3+ | 3.0 | 5.0 |
Fe2+ | 5.8 | 8.8 |
请补充完整由碳酸钙制备甲酸钙的实验步骤 :
步骤1.称取13.6g甲酸钠溶于约20mL水,配成溶待用,并称取研细的碳酸钙样品10g待用。
步骤2._________。
步骤3._________。
步骤4.过滤后,将滤液与甲酸钠溶液混合,调整溶液pH 7~8,充分搅拌,所得溶液经蒸发浓缩、__________、洗涤、60℃时干燥得甲酸钙晶体。
查看答案和解析>>
科目:高中化学 来源:2017届江苏省、溧水高级中学)等六校高三2月联考化学试卷(解析版) 题型:选择题
下列根据实验操作和现象所得出的结论正确的是
选项 | 实验操作及现象 | 结论 |
A | 测定等物质的量浓度的Na2CO3和Na2SO3溶液的pH,前者pH比后者的大 | 非金属性:S>C |
B | 向苯酚浊液中滴加Na2CO3溶液,浊液变澄清 | CO32-结合质子能力比C6H5O-强 |
C | 向10 mL 0.2 mol·L-1NaOH溶液中滴入2滴0.1 mol·L-1MgCl2溶液,产生白色沉淀后,再滴加2滴0.1 mol·L-1FeCl3溶液,白色沉淀转化为红褐色沉淀 | 相同温度下的Ksp:Mg(OH)2>Fe(OH)3 |
D | 将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡、静置,下层溶液显紫红色 | Fe3+的氧化性大于I2 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源:2017届江苏省、溧水高级中学)等六校高三2月联考化学试卷(解析版) 题型:选择题
下列有关化学用于表述正确的是
A. 质子数和中子数均为6的碳原子 C B. 溴化铵的电子式:
C B. 溴化铵的电子式:
C. 氢氧化钠的电子式: D. 2-丙醇的结构简式:
D. 2-丙醇的结构简式: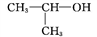
查看答案和解析>>
科目:高中化学 来源:2017届浙江省台州市高三上学期期末质量评估考试化学试卷(解析版) 题型:选择题
为探究固体A的组成和性质,设计实验并完成如下转化。

已知:X由两种化合物组成,若将X通入品红溶液,溶液褪色。若将X通入足量双氧水中,X可全部被吸收且只得到一种强酸,再稀释到1000mL,测得溶液的PH=1。在溶液2中滴加KSCN溶液,溶液呈血红色。请回答:
(1)固体A的化学式______________。
(2)写出反应①的化学方程式____________。
(3)写出反应④中生成A的离子方程式______________。
查看答案和解析>>
科目:高中化学 来源:2017届浙江省台州市高三上学期期末质量评估考试化学试卷(解析版) 题型:选择题
下列说法不正确的是
A. 用烧杯可以精确配制0.1mol/L的NaOH溶液
B. 用淀粉溶液检验某溶液中是否存在碘单质
C. 可利用丁达尔效应区分胶体与溶液
D. 用苯可以萃取溴水中的溴单质
查看答案和解析>>
科目:高中化学 来源:2017届福建省漳州市八校高三2月联考化学试卷(解析版) 题型:选择题
三氟化氮(NF3)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:3NF3+5H2O=2NO+HNO3+9HF.下列有关该反应的说法正确的是( )
A. NF3是氧化剂,H2O是还原剂 B. 还原剂与氧化剂的物质的量之比为2 : 1
C. 若生成0.2 mol HNO3,则转移0.2 mol电子 D. NF3在潮湿的空气中泄漏会产生红棕色气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com