
����Ŀ��(2016������) �±�ΪԪ�����ڱ���һ���֡�
̼ | �� | Y | |
X | �� | Z |
�ش��������⣺
��1��ZԪ�������ڱ��е�λ��Ϊ__________��
��2������Ԫ��ԭ�Ӱ뾶������(дԪ�ط���)__________��
��3��������ʵ��˵��YԪ�صķǽ����Ա�SԪ�صķǽ�����ǿ����__________��
a��Y������H2S��Һ��Ӧ����Һ�����
b����������ԭ��Ӧ�У�1 mol Y���ʱ�1 mol S�õ��Ӷ�
c��Y��S��Ԫ�صļ��⻯�����ȷֽ⣬ǰ�ߵķֽ��¶ȸ�
��4��X��Z��Ԫ�صĵ��ʷ�Ӧ����1 mol X����ۻ�����ָ������£�����687 kJ����֪�û�������ۡ��е�ֱ�Ϊ69 ����58 ����д���÷�Ӧ���Ȼ�ѧ����ʽ��__________��
��5��̼��þ�γɵ�1 mol������Q��ˮ��Ӧ������2 mol Mg(OH)2��1 mol��������������̼��������Ϊ9��1�����ĵ���ʽΪ__________��Q��ˮ��Ӧ�Ļ�ѧ����ʽΪ__________��
��6��ͭ��һ��Ũ�ȵ����������Ļ���ᷴӦ�����ɵ���ֻ������ͭ��ͬʱ���ɵ�������������ϱ�������Ԫ����ɣ��������Է���������С��50��Ϊ��ֹ��Ⱦ����������������ȫת��Ϊ��ۺ������Σ�����1 L 2.2 mol/L NaOH��Һ��1 mol O2������������ķ���ʽ�����ʵ����ֱ�Ϊ__________����������ͭ���ʵ���Ϊ__________��
���𰸡��������ڣ���A�� Si ac Si(s)+2Cl2(g) ![]() SiCl4(l) ��H=687 kJ/mol
SiCl4(l) ��H=687 kJ/mol 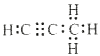 Mg2C3+4H2O
Mg2C3+4H2O![]() 2 Mg(OH)2+C3H4�� NO 0.9 mol��NO21.3 mol 2 mol
2 Mg(OH)2+C3H4�� NO 0.9 mol��NO21.3 mol 2 mol
��������
�������������Ԫ�����ڱ��Ľṹ����֪XΪSiԪ�أ�YΪOԪ�أ�ZΪClԪ�أ�
��1��ClԪ�������ڱ���λ�ڵ������ڣ���A�壬�ʴ�Ϊ���������ڣ���A�壻
��2��ͬһ���ڣ������ң�ԭ�Ӱ뾶��С��ͬһ���壬���ϵ��£�ԭ�Ӱ뾶��������Ԫ��ԭ�Ӱ뾶������Si���ʴ�Ϊ��Si��
��3��a.Y������H2S��Һ��Ӧ����Һ����ǣ�˵�������������Ա���ǿ���Ӷ�˵��YԪ�صķǽ����Ա�SԪ�صķǽ�����ǿ����ȷ��b.�����Ե�ǿ����õ��ӵĶ����أ�����c.Ԫ�صķǽ�����Խǿ���⻯��Խ�ȶ�����ȷ����ѡac��
��4��������д�Ȼ�ѧ����ʽ�ķ������÷�Ӧ���Ȼ�ѧ����ʽΪSi(s)+2Cl2(g)=SiCl4(l)��H=-687kJ/mol���ʴ�Ϊ��Si(s)+2Cl2(g)=SiCl4(l)��H=-687kJ/mol��
��5������������̼��������Ϊ9��1�����ʵ���֮��Ϊ![]() =
=![]() �����̼��þ�γɵ�1mol������Q��ˮ��Ӧ������2molMg(OH)2��1mol����Q�Ļ�ѧʽΪMg2C3�����Ļ�ѧʽΪC3H4������ʽΪ
�����̼��þ�γɵ�1mol������Q��ˮ��Ӧ������2molMg(OH)2��1mol����Q�Ļ�ѧʽΪMg2C3�����Ļ�ѧʽΪC3H4������ʽΪ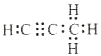 ��Q��ˮ��Ӧ�Ļ�ѧ����ʽΪMg2C3+4H2O=2Mg(OH)2+C3H4�����ʴ�Ϊ��
��Q��ˮ��Ӧ�Ļ�ѧ����ʽΪMg2C3+4H2O=2Mg(OH)2+C3H4�����ʴ�Ϊ��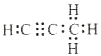 ��Mg2C3+4H2O="2" Mg(OH)2+C3H4����
��Mg2C3+4H2O="2" Mg(OH)2+C3H4����
��6��ͭ��һ��Ũ�ȵ����������Ļ���ᷴӦ��������һ�������Ͷ�����������Է���������С��50���������⣬1molO2���뷴Ӧת�Ƶ��ӵ����ʵ���Ϊ4mol������������������ʵ���Ϊx��һ�����������ʵ���Ϊy����x+y=2.2��x+3y=4�����x=1.3mol��y=0.9mol�����뷴Ӧ��ͭ�����ʵ���Ϊ![]() mol=2mol�������������ͭ���ʵ���Ϊ2mol���ʴ�Ϊ��NO 0.9mol��NO21.3mol��2mol��
mol=2mol�������������ͭ���ʵ���Ϊ2mol���ʴ�Ϊ��NO 0.9mol��NO21.3mol��2mol��


 ���Ͱ�ͨ��ĩ���ϵ�д�
���Ͱ�ͨ��ĩ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ּ�����Ʒ���������������ŷ���������ȫ��Χ�����������ů�ġ������鶨�顷���Ŷ���˹�ļ��룬����2005��2��16����ʽ��Ч���ҹ�������̼���ŷ���λ������ڶ���Ϊ���ٶ�����̼��������������ŷţ����д�ʩ����ʵ�ʵ���
A.������������ԴB.�������̫����
C.��ʹ�ú�̼��ԴD.�����Դ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ�о���ѧϰС���ij��ɫˮ���ijɷֽ��м��飬��֪��ˮ����ֻ���ܺ���K+��Mg2+��Fe3+��Cu2+��Al3+��Ag+��Ca2+��CO![]() ��SO
��SO![]() ��Cl���е����������ӣ���С��ͬѧȡ100mLˮ������ʵ�飬��ˮ�����ȵμ����ᱵ��Һ���ٵμ�1mol/L�����ᣬʵ������г��������ı仯�������ͼ��ʾ������ʾ:Al3+��CO
��Cl���е����������ӣ���С��ͬѧȡ100mLˮ������ʵ�飬��ˮ�����ȵμ����ᱵ��Һ���ٵμ�1mol/L�����ᣬʵ������г��������ı仯�������ͼ��ʾ������ʾ:Al3+��CO![]() �����棩
�����棩

��1��ˮ����һ�����е���������_____�������ʵ���Ũ��֮��Ϊ_____��
��2��д��BC������ʾ��Ӧ�����ӷ���ʽ��_____��
��3����B��C��仯������������������Ϊ_____��
��4���Ը���ʵ�����Ʋ�K+�Ƿ���ڣ�_____���������������������������ڣ�K+�����ʵ���Ũ��c��K+���ķ�Χ��_____������K+�����ڣ��ػش���ʣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݻ�Ϊ50mL����Ͳ�ڳ���NO2��O2�Ļ�����壬������Ͳ��ʢ��ˮ��ˮ����㹻ʱ�����Ͳ��ʣ���������Ϊ5mL������������NO2��O2����ȿ�����( )
A. 13:7B. 15:7
C. 18:7D. 20:7
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ�����ʵ���Ũ�ȵ�KOH��Һʱ������Ũ��ƫ�͵�ԭ�������( )
A. ����ʱ���ӿ̶��ߺ�Һ��
B. ����ƿ��ԭ������������ˮ
C. ��Һʱ��������Һ������ƿ��
D. ����ƿʢ��KOH��Һ��ʹ��ǰδϴ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ˮ�������ᣬ���������Լ���ҽ�÷���������������������һ���Ʊ��������Ƶ�ʵ�鷽�����ش��������⣺
��һ��̼��Ƶ��Ʊ�

��1�����������백ˮ��Ŀ����_______��С����е�������ʹ������������������____��
��2����ͼ��ijѧ���Ĺ��˲���ʾ��ͼ����������淶����______�����ţ���

a��©��ĩ�˾���δ�����ձ���
b����������������
c������ֽʪ��ʹ�����©����
d����ֽ��Ե�߳�©��
e���ò�������©������������Լӿ�����ٶ�
(��)�������Ƶ��Ʊ�

��3���������ľ������Ϊ��μ���ϡ���ᣬ����Һ���д����������壬��ʱ��Һ��____�ԣ���������������������������������Һ��У����ȹ��ˡ�����Һ��е�������___________��
��4���������з�Ӧ�Ļ�ѧ����ʽΪ________���÷�Ӧ��Ҫ�ڱ�ԡ�½��У�ԭ����_________��
��5�������˵õ��İ�ɫ�ᾧ����ʹ������ˮ���Ҵ�ϴ�ӣ�ʹ���Ҵ�ϴ�ӵ�Ŀ����_______��
��6���Ʊ��������Ƶ���һ�ַ����ǣ���ʯ��ʯ���պ�ֱ�Ӽ���˫��ˮ��Ӧ�����˺�ɵõ��������Ʋ�Ʒ���ù��շ������ŵ���______����Ʒ��ȱ����_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ���ô��Σ���Ca2����Mg2����SO42�������ʣ�Ϊ��Ҫԭ�ϲ��á������Ƽ����������ͻ���NH4Cl������������ͼ��ʾ�������й�˵����ȷ���ǣ�������

A. �Դ�����Һ���ӿ����μ���NaOH��Na2CO3��BaCl2���ټ������������ҺpH
B. �������еõ������õ����ܽ�ȵIJ�����
C. ����ͼ�е�ϵ�в������õ��IJ������������в��������ձ���©����������
D. ����ʳ��ˮ����ͨ�������ΪCO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʯ�Ҹ���������������ƺ���������ɵĹ������������������ü�ʯ�����������(����)
A.�Ȼ���B.����C.������̼D.��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ȷ����
ѡ�� | ��ʵ | ԭ�� |
A | �Ʊ�����ú���� | ���ڿ����лᷢ���仯 |
B | ��¶���ڿ����У�Ѹ�ٱ䰵 | ����������Ӧ���ɹ������� |
C | ����ˮ��Ӧ������̪�Լ�����Һ��� | �м����������� |
D | ���ڼ�������������������Ӧ���ɵ���ɫ���� | ���л�ԭ�� |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com