
 ,该烯烃可能的结构有( )
,该烯烃可能的结构有( )| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
科目:高中化学 来源: 题型:选择题
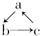 (“→”表示一步完成)关系相互转化的有( )
(“→”表示一步完成)关系相互转化的有( )| 物质 编号 | a | b | c |
| 1 | Na | Na2O2 | NaCl |
| 2 | NaOH | NaHCO3 | Na2CO3 |
| 3 | Al2O3 | NaAlO2 | Al(OH)3 |
| 4 | AlCl3 | Al(OH)3 | NaAlO2 |
| 5 | FeO | Fe(NO3)2 | Fe(OH)2 |
| 6 | MgCl2 | Mg(OH)2 | MgO |
| 7 | CuO | CuSO4 | Cu(OH)2 |
| 8 | Si | SiO2 | H2SiO3 |
| 9 | C | CO | CO2 |
| A. | 1项 | B. | 2项 | C. | 3项 | D. | 4项 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
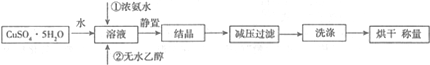

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氟酸密闭存放于玻璃瓶中 | |
| B. | 硅主要以氧化物和硅酸盐形式存在于自然界中 | |
| C. | 铝是地壳中含量最多的金属元素 | |
| D. | 钢是用量最大、用途最广泛的合金 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1种 | B. | 2种 | C. | 4种 | D. | 8种 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | c(Cl-)>c(NH4+)>c(H+)>c(OH-) | B. | c(Cl-)>c(H+)>c(NH4+)>c(OH-) | ||
| C. | c(NH4+)>c(Cl-)>c(OH-)>c(H+) | D. | c(OH-)>c(H+)>c(Cl-)>c(NH4+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
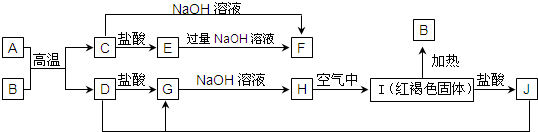
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的比例模型: | |
| B. | 甲基的电子式: | |
| C. | 乙醇的分子式C2H6O | |
| D. | 中子数为53、质子数为78的碘原子:${\;}_{53}^{131}$I |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com