
【题目】用一种试剂除去下列各物质中的杂质(括号内为杂质),并写出离子方程式。
(1)BaCl2(HCl):试剂________,离子方程式___________。
(2)CO2(HCl):试剂________,离子方程式__________。
(3)![]() (CO
(CO![]() )试剂______________________,离子方程式______
)试剂______________________,离子方程式______
(4)C粉(Fe2O3):试剂____,离子方程式___________。
【答案】BaCO3 BaCO3+2H+═Ba2++H2O+CO2↑ 饱和NaHCO3溶液 HCO3-+H+═H2O+CO2↑ H2SO4 CO32-+2H+=CO2↑+H2O 稀盐酸 Fe2O3+ 6H+═2Fe2++3H2O
【解析】
(1)除杂不能引入新的杂质,故可选用BaCO3除去HCl,离子方程式为:BaCO3+2H+═Ba2++H2O+CO2↑,故答案为:BaCO3,BaCO3+2H+═Ba2++H2O+CO2↑;
(2)HCl与碳酸氢钠反应生成二氧化碳,则选择试剂为饱和NaHCO3溶液,发生的离子反应为HCO3-+H+═H2O+CO2↑,故答案为:饱和NaHCO3溶液;HCO3-+H+═H2O+CO2↑;
(3)因除去CO32-一般将其转化为气体,溶液中的阴离子为SO42-,所以选用H2SO4,故答案为:H2SO4 ;CO32-+2H+=CO2↑+H2O;
(4)Fe2O3能与稀盐酸反应生成氯化铁和水而溶解,碳不与盐酸反应,过滤后除去,发生的离子反应为Fe2O3+ 6H+═2Fe2++3H2O,故答案为:稀盐酸;Fe2O3+ 6H+═2Fe2++3H2O。


 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:
【题目】若某氯原子质量是![]() ,
,![]() 的原子质量是
的原子质量是![]() ,
,![]() 是阿伏加德罗常数的值,下列说法不正确的是
是阿伏加德罗常数的值,下列说法不正确的是
A.该氯原子的相对原子质量数值是![]() 或
或![]()
B.![]() 该氯原子的物质的量是
该氯原子的物质的量是![]() mol
mol
C.该氯元素的摩尔质量是![]()
D.![]() 该氯原子所含质子数是
该氯原子所含质子数是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象以及结论完全对应的是
实验操作 | 实验现象 | 结论 | |
A | 0.1 mol/L MgSO4溶液中滴加过量NaOH 溶液,再滴加 0.1 mol/L CuSO4溶液 | 先生成白色沉淀,后变为浅蓝色沉淀 | Cu(OH)2溶度积比Mg(OH)2小 |
B | 将水蒸气通过灼热的铁粉 | 铁粉变为红色 | 铁可以与水在高温下发生反应 |
C | 向酸性KMnO4溶液中滴加乙醇 | 溶液褪色 | 乙醇具有还原性 |
D | 向FeCl3和BaCl2混合溶液中通入足量SO2 | 溶液变为浅绿色且有白色沉淀生成 | Fe3+被还原为Fe2+,白色沉淀为BaSO3 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1L密闭容器中进行如下反应:X(g)+3Y(g)![]() 2Z(g),达到平衡时 X、Y、Z的物质的量分别为 0.1mol、0.3mol、0.2mol,保持温度和容器体积不变时,再向容器中充入X、Y、Z的物质的量0.1mol、0.3mol、0.2mol,则下列说法正确的是
2Z(g),达到平衡时 X、Y、Z的物质的量分别为 0.1mol、0.3mol、0.2mol,保持温度和容器体积不变时,再向容器中充入X、Y、Z的物质的量0.1mol、0.3mol、0.2mol,则下列说法正确的是
A. 化学平衡常数不变,平衡不移动 B. 向正反应方向移动
C. 向逆反应方向移动 D. 容器内压强始终保持原来的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下12种物质为中学化学中常见的物质:
①Cu ②NaCl ③NaHSO4 ④SO3 ⑤H2SO4⑥C2H5OH ⑦CaCO3 ⑧BaSO4 ⑨Cu(OH)2⑩Fe(OH)3 ![]() NaOH
NaOH ![]() NH3·H2O
NH3·H2O
请回答下列问题(填序号)。
(1)属于电解质的是_____。
(2)属于非电解质的是_____。
(3)在水溶液中能导电的电解质是_____。
(4)属于弱电解质的是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水煤气法制取甲醇(CH3OH)的反应及其反应的焓变、平衡常数如下:
① CH4(g) +1/2O2(g)![]() CO(g) + 2H2(g) △H1 =-35.4kJ·mol-1 平衡常数K1
CO(g) + 2H2(g) △H1 =-35.4kJ·mol-1 平衡常数K1
② CO(g) + 2H2(g) ![]() CH3OH (g) △H2 =-90.1 kJ·mol-1 平衡常数K2
CH3OH (g) △H2 =-90.1 kJ·mol-1 平衡常数K2
③ 2CH4(g) + O2(g) ![]() 2CH3OH(g) △H3 平衡常数K3
2CH3OH(g) △H3 平衡常数K3
(1)在25℃、101kPa下,1g液态甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为_________________________________。
(2)依据盖斯定律求出反应③ 2CH4(g) + O2(g) ![]() 2CH3OH(g) △H3 =_____kJ·mol-1,相同温度下K3=______(用含K1、K2代数式表示)。
2CH3OH(g) △H3 =_____kJ·mol-1,相同温度下K3=______(用含K1、K2代数式表示)。
(3)下列关于化学反应中的能量及变化理解错误的是(填字母序号)______。
a.反应中活化能的作用是使反应物活化,从而启动反应或改变反应速率
b.化学键的断裂与形成一定伴随着电子的转移和能量变化
c.在一定条件下,某一化学反应是吸热反应还是放热反应,由生成物与反应物的焓值差即焓变(△H)决定
d.氯化钠晶体熔化时,离子键被破坏,吸收能量,发生化学变化
e.200℃、101kPa时,1 mol H2和碘蒸气作用生成HI的反应,热化学方程式表示如下:H2(g)+I2(g) === 2HI(g) △H= -14.9 kJ·mol-1
f.燃烧热定义中“生成稳定的氧化物”,意味着这些氧化物不能再燃烧了
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氧化二镍(Ni2O3)是一种重要的电子元件材料和蓄电池材料。工业上利用含镍废水(镍主要以NiR2络合物形式存在)制取草酸镍(NiC2O4),再高温灼烧草酸镍制取三氧化二镍。工艺流程如图所示:
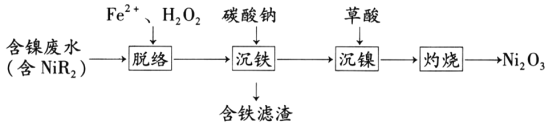
已知:①NiR2(aq)![]() Ni2+(aq)+2R-(aq)(R-为有机物配体,K=1.6×10-14)
Ni2+(aq)+2R-(aq)(R-为有机物配体,K=1.6×10-14)
②Ksp[Fe(OH)3]=2.16×10-39,Ksp[Ni(OH)2]=2×10-15
③Ka1(H2C2O4)= 5.6×10-2,Ka2(H2C2O4)= 5.4×10-5
④“脱络”过程中,R-与中间产物·OH反应生成·R(有机物自由基),·OH能与H2O2发生反应。有关反应的方程式如下:
i.Fe2++H2O2=Fe3++OH-+·OH
ii.R-+·OH = OH-+·R
iii.H2O2+2·OH=O2↑+2H2O
请回答下列问题:
(1)中间产物·OH的电子式是________
(2)“沉铁”时,若溶液中c(Ni2+)=0.01mol·L-1,加入碳酸钠调溶液的pH为________(假设溶液体积不变,lg6≈0.8)使Fe3+恰好沉淀完全(离子的浓度≤1.0×10-5mol·L-1),此时________(填“有”或“无”)Ni(OH)2沉淀生成。
(3)25℃时,pH=3的草酸溶液中c(C2O42-)/c(H2C2O4)________(保留两位有效数字)。“沉镍”即得到草酸镍沉淀,其离子方程式是________
(4)“灼烧”氧化草酸镍的化学方程式为_______________________________。
(5)加入Fe2+和H2O2能够实现“脱络”的原因是________。
(6)三氧化二镍能与浓盐酸反应生成氯气,写出反应的离子方程式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计了如下实验装置,进行浓硫酸与蔗糖的反应实验。

(1)实验开始时,先在烧瓶中加入15g蔗糖,并滴入几滴水使蔗糖完全湿润,然后从分液漏斗中加入15mL浓硫酸,水的作用是_________。
(2)实验中烧瓶内黑色物质疏松膨胀的原因是________(用化学方程式表示)。
(3)为了检验实验中产生的CO2,请描述接口a之后的实验操作及现象_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式是( )
A. 向水中通入氯气:Cl2+H2O2H++Cl﹣+ClO﹣
B. 二氧化锰与浓盐酸反应:MnO2+4HCl(浓)![]() Mn2++2Cl2↑+2H2O
Mn2++2Cl2↑+2H2O
C. 碳酸氢钠溶液加过量澄清石灰水:2HCO3﹣+Ca2++2OH﹣═CaCO3↓+2H2O+CO32﹣
D. 金属钠与硫酸铜溶液反应:2Na+2H2O+Cu2+═2Na++Cu(OH)2↓+H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com