
下列溶液中的离子—定能大量共存的是
A. 含大量 MnO4-的溶液中:Na+、K+、Cu2+、Fe3+
B. 在加入铝粉能产生氢气的溶液中:NH4+、Fe2+、SO42-、NO3-
C. 酸性溶液中:Ba2+、NO3-、K+、AlO2-
D. 含大量 Fe3+的溶液中:NH4+、Na+、I-、SCN-
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源:2016-2017学年江西省南昌市高一上学期期末考试化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A. 在过氧化钠与水的反应中,固体每增重mg,转移电子的数目为mNA
B. 标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA
C. 已知反应: 2NH3+NO+NO2=2N2+3H2O,每生成2mol N2转移的电子数目为6NA
D. 标准状况下,1 mol CCl4的体积为22.4L
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省安庆市高一上学期期末考试化学试卷(解析版) 题型:选择题
下列物质互相反应,反应产物随两种物质的用量不同而不同的是
①铁与氯气 ②氢氧化钠与二氧化碳 ③铁与稀硝酸 ④铜与硫粉
⑤盐酸与碳酸钠 ⑥氯化铝与浓氨水 ⑦硫化氢与氧气
A. ②③⑤⑦ B. ②③⑤⑥⑦
C. ①②③⑤⑥⑦ D. ①②③④⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省安庆市高一上学期期末考试化学试卷(解析版) 题型:选择题
生活与化学息息相关,下列有关生活中化学物质的说法错误的是
A. 食盐中加入KIO3可以预防缺碘性大脖子病
B. 常用硅胶做袋装膨化油脂性食品的抗氧化剂
C. 食用铁强化酱油可以控制铁缺乏和缺铁性贫血
D. 食用苏打饼干可以缓解胃酸过多
查看答案和解析>>
科目:高中化学 来源:湖南省长沙市2016-2017学年高一上学期期末考试化学试卷 题型:填空题
化学与人类生活密切相关。请按要求,回答下列问题:
(1)酸雨的pH小于______________。
(2)漂白粉有效成分的化学式为______________,其能消毒杀菌是因有强_________性。
(3)小苏打可用于治疗胃酸过多,其反应的离子方程式为_____________。
⑷KA1(SO4)2 • 12H2O的俗名为_________,因其溶于水生成______________(化学式)而具有净水作用。
(5)向一铝制易拉罐中充满CO2后,再往罐中注入足量的质量分数为20%的NaOH溶液,立即严封罐口,不—会儿就发现易拉罐变瘪,再过一会易拉罐又鼓胀起来,解释上述实验现象,易拉罐又鼓胀起来的原因是________________(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源:湖南省长沙市2016-2017学年高一上学期期末考试化学试卷 题型:选择题
用NA表示阿伏加德罗常数的数值,下列说法正确的是
A. 1 mol Cl2与足量的铁反应转移的电子数是2NA
B. 常温常压下22. 4 L HC1气体含有的分子数是NA
C. 0.1 mol • L-1 CuCl2 溶液中Cl-数目是0.2 NA
D. 32 gO2中含有的原子数是NA
查看答案和解析>>
科目:高中化学 来源:2017届云南省高三高考适应性月考(六)理综化学试卷(解析版) 题型:填空题
[化学-选修3:物质结构与性质]
硫是一种重要的非金属元素,广泛存在于自然界,回答下列问题:
(1)基态硫原子的价层电子排布图是_________________。
(2)①硫单质的一种结构为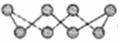 ,杂化方式为______________,该物质___________(填“可溶”或“难溶”)于水,该晶体中存在的作用力___________、_____________。
,杂化方式为______________,该物质___________(填“可溶”或“难溶”)于水,该晶体中存在的作用力___________、_____________。
②SO42-、CS2、CO32-键角由大到小的顺序是_________________。
(3)含硫的物质的特殊性质与其结构相关。
①熔点:SF6 _______A1F3(填“>”或“<”),原因是___________________。
②分析并比较 与
与 的沸点高低:___________________。
的沸点高低:___________________。
(4)ZnS晶胞如图所示:
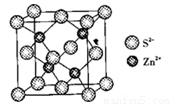
①由图可知,Zn2+填在了S2-形成的______________空隙中。
②已知晶胞密度为, g/cm3,阿伏加德罗常数为NA,则晶胞边长为__________pm。
g/cm3,阿伏加德罗常数为NA,则晶胞边长为__________pm。
查看答案和解析>>
科目:高中化学 来源:2017届云南省昆明市新课标高三月考卷(六)理综化学试卷(解析版) 题型:选择题
某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理如图所示。下列有关说法正确的是
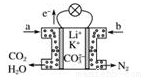
A. a为空气,b为CH4
B. CO32-向正极移动,K+、Li+向负极移动
C. 负极电极反应式为CH4-8e-+4CO32-=5CO2+2H2O
D. 正极电极反应式为O2+4e-+2H2O=4OH
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省揭阳市高二下学期第一次月考理科综合化学试卷(解析版) 题型:填空题
钠及其化合物具有广泛的用途。
(1)工业上制备金属钠的常用方法是_______。试写出制备金属钠的化学方程式_____________。金属钠可用于________________(写出Na在熔点低方面的一种用途)。
(2)用Na2CO3熔融盐作电解质,CO、O2、CO2为原料可组成新型电池。该电池的结构如图所示:

①正极的电极反应式为_______,电池工作时物质A可循环使用,A物质的化学式为_______。
②请写出检验Na2CO3中钠元素的方法_________________________。
(3)常温下,浓度均为0.1 mol·L-1的下列五种钠盐溶液的pH如下表:
溶质 | CH3COONa | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 11.6 | 10.3 | 11.1 |
上述盐溶液的阴离子中,结合H+能力最强的是_________,根据表中数据,浓度均为0.01 mol·L-1的下列四种酸的溶液分别稀释100倍,pH变化最大的是_______(填序号)。
a.HCN b.HClO c.CH3COOH d.H2CO3
(4)实验室中常用NaOH来进行尾气处理、洗气和提纯。
①常温下,当300 mL 1 mol·L-1的NaOH溶液吸收4.48 L(折算成标准状况)SO2时,所得溶液pH>7,则溶液中各离子浓度由大到小的顺序为_______。
②已知几种离子开始沉淀时的pH如下表:
离子 | Fe2+ | Cu2+ | Mg2+ |
pH | 7.6 | 5.2 | 10.4 |
当向含相同浓度Cu2+、Mg2+、Fe2+的溶液中滴加某浓度的NaOH溶液时,_______(填离子符号)先沉淀,Ksp_______Ksp(填“>”、“=”或“<”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com