
 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源:2016-2017学年山东省高一下学期开学考试化学试卷(解析版) 题型:选择题
下列根据事实推出的结论正确的是( )
A. SiO2不溶于水,而Na2O2溶于水得到NaOH,则SiO2不是酸性氧化物,Na2O2为碱性氧化物
B. NaHSO4溶液、Na2CO3溶液分别呈酸性、碱性,则NaHSO4属于酸,Na2CO3属于碱
C. HCl、NH3的水溶液都能导电,则HCl、NH3均属于电解质
D. 用一束光照射稀豆浆时产生丁达尔效应,则稀豆浆属于胶体
查看答案和解析>>
科目:高中化学 来源:2017届湖南省衡阳市高三实验班第六次月考理综化学试卷(解析版) 题型:选择题
下列有机反应属于加成反应的是
A.CH4 + Cl2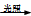 CH3Cl + HCl
CH3Cl + HCl
B.CH2==CH2 + Br2 CH2BrCH2Br
CH2BrCH2Br
C.2CH3CH2OH + O2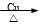 2CH3CHO + 2H2O
2CH3CHO + 2H2O
D.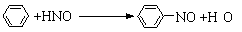
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省大同市高一3月月考化学试卷(解析版) 题型:填空题
利用元素周期表,我们可以认识更多元素的性质
(1)元素周期表位于对角线的两种元素其性质相似称之为对角线规则。根据周期表对角线规律, 金属Be单质及其化合物的性质与铝单质及其化合物的性质相似。则鉴别说Be(OH)2和Mg(OH)2可选用的试剂为__________溶液。
(2)铅(Pb)、锡(Sn)、锗(Ge)与元素(C)、硅(Si)同主族,常温下其单质在空气中,锡、锗不反应而铅表面生成一层氧化铅;锗与盐酸不反应,而锡与盐酸反应。由此可得出以下结论:
① 锗的原子序数为__________;
② 铅(Pb)、锡(Sn)、锗(Ge)的+4价氢氧化物的碱性由强到弱的顺序为__________(填化学式)。
(3)最近,德国科学家实现了铷原子气体超流体态与绝缘态的可逆转换,该成果将在量子计算机研究方面带来最重大突破。己知铷(Rb)是37号元素,质量数是85,与钠同主族。回答下列问题:
①铷在周期表中的位置为___________________
②同主族元素的同类化合物的性质相似,请写出:
AlCl3与过量的RbOH反应的离子方程式:_____________________________
③现有铷和另一种碱金属形成的混合金属50g,当它与足量水反应时,放出标准状况下的氢气22.4L,这种碱金属可能是__________
A.Li B.Na C.K D.Cs
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省大同市高一3月月考化学试卷(解析版) 题型:选择题
A、B、C、D为原子序数依次增大的同周期的短周期元素,己知A、C、D三种元素原子的最外层共有11个电子,且这三种元素的最高价氧化物对应的水化物之间两两皆能反应,均生成盐和水。下列判断正确的是( )
A. C、D的最高价氧化物对应的水化物分別是强碱、强酸
B. A、C、D 三种元素有两种是金属,一种是非金属
C. D元素位于第3周期VIA族
D. A、B、C三种元素阳离子氧化性由强到弱为A>B>C
查看答案和解析>>
科目:高中化学 来源:2017届陕西省高三3月月考理科综合化学试卷(解析版) 题型:简答题
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂。
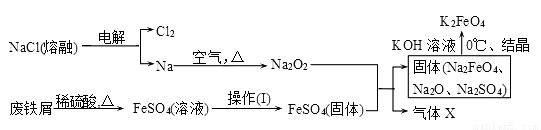
(1)工业上的湿法制备方法是用KClO与Fe(OH)3在KOH存在下制得K2FeO4,该反应氧化剂与还原剂物质的量之比为________________。
(2)实验室用食盐、废铁屑、硫酸、KOH等为原料,通过以下过程制备K2FeO4:
①操作(Ⅰ)的方法为_________________,隔绝空气减压干燥。
②检验产生X气体的方法是________________。
③最终在溶液中得到K2FeO4晶体利用的原理是____________________。
(3)测定某K2FeO4样品的质量分数,实验步骤如下:
步骤1:准确称量1.0g样品,配制100mL溶液,
步骤2:准确量取25.00mL K2FeO4溶液加入到锥形瓶中
步骤3:在强碱性溶液中,用过量CrO2-与FeO42-反应生成Fe(OH)3和CrO42-
步骤4:加稀硫酸,使CrO42-转化为Cr2O72-,CrO2-转化为Cr3+,Fe(OH)3转化为Fe3+
步骤5:加入二苯胺磺酸钠作指示剂,用0.1000mol·L-1 (NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显紫红色),记下消耗(NH4)2Fe(SO4)2溶液的体积,做3次平行实验,平均消耗(NH4)2Fe(SO4)2溶液的体积30.00 mL。
已知:滴定时发生的反应为:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O。
①步骤2中准确量取25.00mL K2FeO4溶液加入到锥形瓶中所用的仪器是______________。
②写出步骤3中发生反应的离子方程式__________________________。
③步骤5中能否不加指示剂_________,原因是________________。
④根据上述实验数据,测定该样品中K2FeO4的质量分数为__________。
(4)配制0.1mol·L-1的K2FeO4,调节溶液pH,含铁离子在水溶液中的存在形态如图所示。下列说法正确的是__________ (填字母)。

A.pH=2时,c(H3FeO4+)+c(H2FeO4)+c(HFeO4-)=0.1mol·L-1
B.向pH=10的这种溶液中加硫酸铵,则HFeO4-的分布分数逐渐增大
C.向pH=1的溶液中加HI溶液,发生反应的离子方程式为:H2FeO4+H+=H3FeO4+
D.将K2FeO4晶体溶于水,水溶液呈弱碱性
查看答案和解析>>
科目:高中化学 来源:2017届陕西省高三3月月考理科综合化学试卷(解析版) 题型:选择题
有a、b、c、d四种元素,原子序数依次增大。a存在a+和a-两种离子,b和c为短周期同一主族元素,c的次外层有8个电子,c2-和d2+的电子层结构相同。下列叙述正确的是( )
A. b和c分别与a形成化合物的相对分子质量一定为b>c
B. a和d形成的化合物与水反应产生的气体可做燃料
C. +6价的c和a、b形成离子化合物
D. a、b、c和d四种元素组成的化合物的水溶液加入少量Na2CO3只产生气体,不产生沉淀
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省太原市高一3月阶段性测试化学试卷(解析版) 题型:填空题
四种短周期元素在周期表中的相对位置如下所示,其中Z元素最外层电子数是其电子层数的2倍。请回答下列问题:
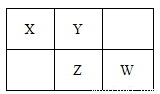
(1)元素Z位于周期表中的位置_____________。
(2)在标准状况下,用充满X元素的氢化物气体及少量空气的混合气体的烧瓶做喷泉实验,实验结束后,则烧瓶中所得溶液的物质的量浓度为____________mol/L(结果保留两位有效数字)。
(3)W、Z的最高价氧化物对应的水化物的酸性大小顺序____________(用化学式表示)。
(4)将W的单质通入含等物质的量FeBr2的溶液中,发生反应的离子方程式为
_______________________________________。
(5)Z和X形成的一种化合物相对分子质量在170~190之间,且Z的质量分数约为70%。该化合物的化学式为___________。
查看答案和解析>>
科目:高中化学 来源:2017届新疆乌鲁木齐地区高三第二次诊断性测验化学试卷(解析版) 题型:选择题
化学与生产、生活、社会密切相关。下列说法正确的是( )
A. 葡萄酒中添加SO2,可起到抗氧化和抗菌的作用
B. PM2.5颗粒分散到空气中可产生丁达尔效应
C. 苯、四氯化碳、乙醇都可作萃取剂,也都能燃烧
D. 淀粉、油脂、纤维素和蛋白质都是高分子化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com