
| 实验现象 | 结论 | |
| 实验① | ||
| 实验② |
| ||


科目:高中化学 来源: 题型:
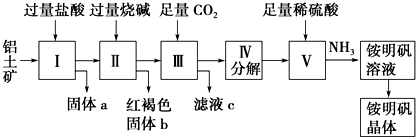
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 生理盐水,是指生理学实验或临床上常用的渗透压与动物或人体血浆的渗透压相等的氯化钠溶液.浓度:用于两栖类动物时是0.67~0.70%,用于哺乳类动物和人体时是0.85~0.9%人们平常点滴用的氯化钠注射液浓度是0.9%,可以当成生理盐水来使用.请回答下面有关点滴用的氯化钠注射液的问题.
生理盐水,是指生理学实验或临床上常用的渗透压与动物或人体血浆的渗透压相等的氯化钠溶液.浓度:用于两栖类动物时是0.67~0.70%,用于哺乳类动物和人体时是0.85~0.9%人们平常点滴用的氯化钠注射液浓度是0.9%,可以当成生理盐水来使用.请回答下面有关点滴用的氯化钠注射液的问题.查看答案和解析>>
科目:高中化学 来源: 题型:
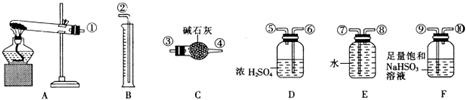
| 实验小组 | 称取硫酸铜的质量(g) | 装置c增加的质量(g) | 量筒中谁的体积折算成标准状况下气体的体积(mL) |
| 一 | 6.4 | 2.56 | 448 |
| 二 | 6.4 | 3.84 | 224 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验方案 | 实验现象 |
| 1.用砂纸擦后的镁带与沸水反应,再向反应液中滴加酚酞 2.向新制的H2S饱和溶液中滴加氯水 3.钠与滴有酚酞试液的冷水反应 4.镁带与2mol/L的盐酸反应 5.铝条与2mol/L的盐酸反应 6.向AlCl3溶液中滴加NaOH溶液至过量 | A.浮于水面,熔成小球,四处游动,逐渐缩小,溶液变红色 B.产生大量气体,气体可燃,溶液变浅红色 C.反应不十分强烈,产生的气体可燃 D.剧烈反应,产生的气体可燃 E.生成白色絮状沉淀,继而沉淀消失 F.生成淡黄色沉淀 |
| 实验方案 | 实验现象 | 有关离子方程式 |
| A | ||
| B | 不 填 | |
| C | 不 填 | |
| D | 不 填 | |
| E | ||
| F |
查看答案和解析>>
科目:高中化学 来源: 题型:
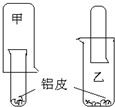 为了适应“低碳生活”,某化学兴趣小组用铝制废牙膏皮、一大一小两种试管和稀硫酸来制取并收集一试管氢气.据此完成下列要求.
为了适应“低碳生活”,某化学兴趣小组用铝制废牙膏皮、一大一小两种试管和稀硫酸来制取并收集一试管氢气.据此完成下列要求.查看答案和解析>>
科目:高中化学 来源: 题型:
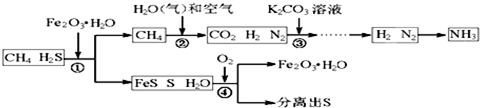
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com