
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(1)氯气是最早用于饮用水消毒的物质,其消毒作用主要是氯气溶于水后生成了次氯酸,该反应的离子方程式为__________________,多余的氯气可用绿矾吸收,反应的离子方程式为____________________________________________________________________。
(2)氯气用于自来水消毒除有异味外,近来发现能产生500多种有致癌、致畸作用的有机氯衍生物,如CHCl3、CCl2Br2等。写出CH4与Cl2反应生成CHCl3的化学方程式:
__________________;__________________;__________________。
以上反应均属于_________反应(填有机反应类型),由此可知,每生成1 mol CHCl3,消耗Cl2的物质的量_________ (填“大于”“等于”或“小于”)3 mol。
(3)用高铁酸钠(Na2FeO4)对来自河、湖的淡水消毒是城市饮用水处理新技术,下列对Na2FeO4能用于饮用水消毒和净化处理的原因分析正确的是( )
A.Na2FeO4在溶液中显强碱性,能消毒杀菌
B.Na2FeO4的还原产物是Fe3+,易水解生成Fe(OH)3,可使水中悬浮物凝聚沉降
C.Na2FeO4的还原产物是Fe2+,易水解为Fe(OH)2,可使水中悬浮物凝聚?沉降
D.Na2FeO4中Fe为+6价,具有强氧化性,能消毒杀菌
高铁(Ⅵ)酸盐是新一代水处理剂,其制备方法有次氯酸盐氧化法(湿法):该法是在碱性溶液中,利用次氯酸盐氧化三价铁盐,试写出并配平这一离子反应方程式:__________________。
(4)我国南方某些地区的井水取来久置后,由澄清透明变成有少量棕红色絮状沉淀沉积于缸底,水面浮着一层“锈皮”,当地居民常采用加明矾的方法处理。①井水久置后,水面浮着的一层“锈皮”的主要成分是_________(写化学式)。②用化学方法鉴别该井水的步骤是__________________;离子方程式是__________________。③用化学方法鉴别经明矾处理后的水的步骤是__________________;离子方程式是__________________。④AlCl3·6H2O(代号AC)和[Al2(OH)nCl6-n]m(代号BAC)都可以作为水澄清剂。它们对水的pH改变的影响是否一样大?_________;原因是什么?__________________。
(5)X物质也可用于自来水消毒,既能提高消毒效率,又安全、无异味、无副作用,该物质在自然界中存在,对地球生物起保护伞作用。X的化学式是_________。X能使湿润的淀粉碘化钾试纸变蓝,试写出该反应的化学方程式:__________________。该反应过程中氧化产物和还原产物的物质的量之比为_________。
(6)ClO2被称为“第四代”饮用水杀菌剂,因其高效、无污染而被广泛使用。我国北京永利科技有限公司已用电解法批量生产ClO2。其反应原理为![]() +4 H+
+4 H+![]() 4ClO2↑+O2↑+2H2O,从反应原理看,应在酸性条件下进行,能否用盐酸调节溶液的酸性?
4ClO2↑+O2↑+2H2O,从反应原理看,应在酸性条件下进行,能否用盐酸调节溶液的酸性?
答:________(填“能”或“不能”),理由是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

查看答案和解析>>
科目:高中化学 来源: 题型:
某研究小组用如下图装置进行铜与浓硫酸反应的实验研究。
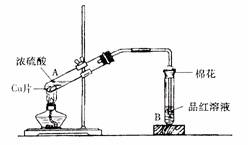
(1)写出铜与浓硫酸反应的化学方程式 ;
(2)B试管口堵的棉花喷有的试剂是 ;
(3)充分反应后,研究小组同学发现铜和硫酸都有剩余。在不补充浓硫酸的前提下,加入下列物质不能使剩余铜片溶解的是 (填写序号);
①KNO3 ②FeCl3 ③Fe2O3 ④HCl
(4)研究小组同学向反应后的溶液中加入足量的氧化铜,使剩余的硫酸全部转化为硫酸铜,过滤后,将滤液加热浓缩,冷却结晶制得硫酸铜晶体(CuSO4?xH2O)。研究小组同学采用加热法测定该晶体里结晶水x的值。
①在他们的实验操作中,至少称量 次;
②下面是其中一次实验的数据:
| 坩埚质量 | 坩埚与晶体总质量 | 加热后坩埚与固体总质量 |
| 11.7g | 22.7g | 19.7g |
根据上表数据计算x的实测值为 ,这次实验中产生误差的原因可能是
(填序号)。
A.硫酸铜晶体中含有不挥发性杂质 B.实验前晶体表面有湿存水
C.加热时有晶体飞溅出去 D.加热失水后露置在空气中冷却
(5)研究小组同学发现,反应后的A试管中还得到一种黑色的固体,经鉴定它是两种元素形成的盐,元素间的质量比为2:1,其化学式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com