
| A. | 苯与溴水充分振荡后,溴水层褪色说明苯分子中的碳原子没有饱和 | |
| B. |  的最简式相同 的最简式相同 | |
| C. | 苯分子是环状结构,只有6个碳原子在同一平面上 | |
| D. | 苯的邻位二元取代物只有一种可以说明苯分予不具有碳碳单键和碳碳双键的交替结构 |
分析 A,苯和溴水不发生反应,混合后只是发生萃取褪色;
B.C2H2最简式为CH,甲苯分子式为C7H8;
C.苯分子中氢原子和碳原子都共平面;
D.苯的邻位二元取代物只有一种,说明六个碳碳键完全相同的化学键;
解答 解:A,苯和溴水不发生反应,混合后只是发生萃取褪色,不能说明苯分子中的碳原子的饱和程度,故A错误;
B.C2H2最简式为CH,甲苯分子式为C7H8,最简式不同,故B错误;
C.苯分子是环状结构,苯分子中6个氢原子和6个碳原子都共平面,故C错误;
D.苯的邻位二元取代物只有一种,说明六个碳碳键完全相同的化学键,分子结构中不存在单双建交替的化学键,故D正确;
故选D.
点评 本题考查了苯、苯的同系物结构和性质的理解应用,注意苯环中六个碳碳化学键相同,苯及其苯的同系物和溴水不反应,题目较简单.


 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙醇与乙酸的反应条件通常是浓硫酸、加热 | |
| B. | 充分反应可以生成1mol乙酸乙酯 | |
| C. | 生成的乙酸丙酯和水的物质的量之比是1:2 | |
| D. | 反应结束时,剩余2mol乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KOH | B. | KAl(SO4)2 | C. | KHCO3 | D. | K2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 $→_{催化剂}^{H_{2}(足量)}$A$\stackrel{HBr}{→}$B$→_{干醚}^{Mg}$
$→_{催化剂}^{H_{2}(足量)}$A$\stackrel{HBr}{→}$B$→_{干醚}^{Mg}$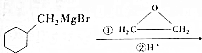 C$→_{Cu,△}^{O_{2}}$
C$→_{Cu,△}^{O_{2}}$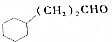 $→_{H+}^{KMnO_{4}}$D$→_{浓H_{2}SO_{4},△}^{E}$
$→_{H+}^{KMnO_{4}}$D$→_{浓H_{2}SO_{4},△}^{E}$
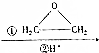 RCH2CH2OH+
RCH2CH2OH+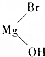
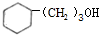 .
. 的化学方程式2
的化学方程式2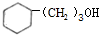 +O2$\stackrel{Cu}{→}$
+O2$\stackrel{Cu}{→}$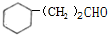 +2H2O,反应类型为氧化反应.
+2H2O,反应类型为氧化反应. ,反应类型为酯化反应.
,反应类型为酯化反应.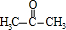 ,名称为丙酮.
,名称为丙酮.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 测定序号 | 待测溶液的体积(mL) | 所耗盐酸标准液的体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 1 | 20.00 | 0.50 | 20.78 |
| 2 | 20.00 | 1.20 | 21.32 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe2+ | 5.8 | 8.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 TiO2在光照射下可使水电解:2H2O$\frac{\underline{\;TiO_{2}\;}}{光}$在2H2↑+O2↑,该过程类似植物的光合作用.如图是光照射下TiO2分解水的装置示意图.下列叙述正确的是( )
TiO2在光照射下可使水电解:2H2O$\frac{\underline{\;TiO_{2}\;}}{光}$在2H2↑+O2↑,该过程类似植物的光合作用.如图是光照射下TiO2分解水的装置示意图.下列叙述正确的是( )| A. | 该装置可以将光能转化为电能,同时也能转化为化学能 | |
| B. | 铂电极上发生的反应为:H2-2e-=2H+ | |
| C. | 该装置工作时,电流由TiO2电极经R流向铂电极 | |
| D. | 该装置工作时,TiO2电极附近溶液的pH变大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com