
下列反应的离子方程式书写正确的是
A.等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合:Ba2++2OH-+NH +HCO
+HCO =BaCO3↓+NH3·H2O+H2O
=BaCO3↓+NH3·H2O+H2O
B.实验室配制的亚铁盐溶液在空气中被氧化:4Fe2++O2+2H2O=4Fe3++4OH-
C.向碳酸氢铵溶液中加过量石灰水并加热:NH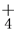 +OH-
+OH- NH3↑+H2O
NH3↑+H2O
D.用酸化的高锰酸钾溶液氧化双氧水:2MnO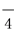 +6H++H2O2===2Mn2++3O2↑+4H2O
+6H++H2O2===2Mn2++3O2↑+4H2O
科目:高中化学 来源:2017届云南曲靖市高三上学期第三次月考化学试卷(解析版) 题型:选择题
某铁的氧化物,用3.5mol/L的盐酸200mL在一定条件下恰好完全溶解,所得溶液再通入1.775g的氯气时,刚好使溶液中Fe2+完全转化为Fe3+.则该氧化物的化学式可表示为
A.FeO
B.Fe3O4
C.Fe4O5
D.Fe5O7
查看答案和解析>>
科目:高中化学 来源:2017届山东师范大学附属中学高三上第二次模拟考试化学试卷(解析版) 题型:填空题
电解原理在化学工业中有广泛应用。
(1)电解食盐水是氯碱工业的基础。目前比较先进的方法是阳离子交换膜法,电解示意图如图所示,图中的阳离子交换膜只允许阳离子通过,请回答以下问题:

①图中A极要连接电源的______(填“正”或“负”)极。
②精制饱和食盐水从图中_____位置补充,氢氧化钠溶液从图中____位置流出。(选填“a”、“b”、“c”、“d”、“e”或“f”)
③电解总反应的离子方程式是___________________________________。
(2)电解法处理含氮氧化物废气,可回收硝酸,具有较高的 环境效益和经济效益。实验室模拟电解法吸收NOx的装置如图所示(图中电极均为石墨电极)。若用NO2气体进行模拟电解法吸收实验。
环境效益和经济效益。实验室模拟电解法吸收NOx的装置如图所示(图中电极均为石墨电极)。若用NO2气体进行模拟电解法吸收实验。
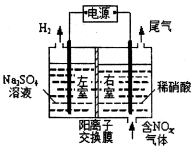
①写出电解时NO2发生反应的电极反应________________________________。
②若有标准状况下2.24LNO2被吸收,通过阳离子交换膜(只允许阳离子通过)的H+为__________mol。
(3)为了减缓钢制品的腐蚀,可以在钢制品的表面镀铝。电解液采用一种非水体系的室温熔融盐,由有机阳离子、A12C17-和AlCl4-组成。
①钢制品应接电源的________极。
②己知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为________________。
③若改用AlCl3水溶液作电解液,则阴极电极反应式为_______________________。
查看答案和解析>>
科目:高中化学 来源:2017届山东省高三10月阶段检测化学试卷(解析版) 题型:填空题
一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在:钴以Co2O3·CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中。 从废料中回收氧
从废料中回收氧 化钴(CoO)工艺流程如下:
化钴(CoO)工艺流程如下:

(1)过程Ⅰ中采用NaOH溶液溶出废料中的Al,反应的离子方程式为。
(2)过程Ⅱ中加入稀H 2SO4酸化后,再加入Na2S2O3溶液浸出钴。则浸出钴的化学反应方程式为(产物中只有一种酸根)。在实验室模拟工业生产时,也可用盐酸浸出钴,但实际工业生产中不用盐酸,请从氧化还原和环境保护的角度分析不用盐酸浸出钴的主要原因。
2SO4酸化后,再加入Na2S2O3溶液浸出钴。则浸出钴的化学反应方程式为(产物中只有一种酸根)。在实验室模拟工业生产时,也可用盐酸浸出钴,但实际工业生产中不用盐酸,请从氧化还原和环境保护的角度分析不用盐酸浸出钴的主要原因。
(3)过程Ⅲ得到锂铝渣的主要成分是LiF和Al(OH)3,碳酸钠溶液在产生Al(OH)3时起重要作用,请写出该反应的离子方程式。
(4)碳酸钠溶液在过程Ⅲ和Ⅳ中所起作用有所不同,请写出在过程Ⅳ中起的作用是。
查看答案和解析>>
科目:高中化学 来源:2017届山东省高三10月阶段检测化学试卷(解析版) 题型:选择题
已知I-、Fe2+、SO2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性的顺序为SO2>I->Fe2+>H2O2>Cl-,则下列反应不可能发生的是
A.2Fe3++SO2+2H2O=2Fe2++SO +4H+
+4H+
B.I2+SO2+2H2O=H2SO4+2HI
C.2Fe2++I2=2Fe3++2I-
D.H2O2+SO2=H2SO4
查看答案和解析>>
科目:高中化学 来源:2017届山东省高三10月阶段检测化学试卷(解析版) 题型:选择题
设NA表示阿伏加德罗常数的值。下列叙述正确的是
A.常温常压下,Na2O2与足量H2O反应,共生成0.2molO2,转移电子的数目为0.4NA
B.密闭容器中46gNO2含有的分子数为NA
C.常温常压下,7.0g乙烯与丙烯的混合物中含有氢原子的数目为2NA
D.标准状况下,1LHCl和1LH2O的物质的量相同
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省瓦房店市高一上10月月考化学试卷(解析版) 题型:选择题
下 列说法正确的是:[
列说法正确的是:[
A.同温同压下,相同数目的分子具有相同的体积
B.等质量的O2和H2的物质的量之比为16:1
C.不同的气体若体积不等,则它们所含的分子数一定不等
D.同温同体积下,两种气体的物质的量之比等于压强之比
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省瓦房店市高二上10月月考化学试卷(解析版) 题型:选择题
25 ℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s) + Pb2+(aq) Sn2+(aq) + Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是
Sn2+(aq) + Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是

A.往平衡体系中加入金属铅后,c(Pb2+)增大
B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小
C.升高温度,平衡体系中c(Pb2+)增大,说明该反应ΔH>0
D.25 ℃时,该反应的平衡常数K=2.2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省宜春市高二上月考一化学试卷(解析版) 题型:实验题
实验室中有一未知浓度的稀盐酸,某学生用0.10 mol·L-1 NaOH标准溶液进行测定盐酸的浓度的实验。取20.00 mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。请完成下列填空:

实验编号 | 待测盐酸的体积(mL) | NaOH溶液的浓度(mol·L-1) | 滴定完成时,NaOH溶液滴入的体积(mL) |
1 | 20.00 | 0.10 | 24.18 |
2 | 20.00 | 0.10 | 23.06 |
3 | 20.00 | 0.10 | 22.96 |
I、(1)滴定达到终点的标志是是 。
(2)根据上述数据,可计算出该盐酸的浓度约为 (保留小数点后2位)。
(3)排除碱式滴定管尖嘴中气泡的方法应采用 操作,然后轻轻挤压玻 璃球使尖嘴部分充满碱液。 (4)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有 。
(4)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有 。
A.用酸式滴定管取20.00 mL待测盐酸,使用前,水洗后未用待测盐酸润洗
B.锥形瓶水洗后未干燥
C.称量NaOH固体时,有小部分NaOH潮解
D.滴定终点读数时俯视
E.碱式滴定管尖嘴部分有气泡,滴定后消失
II、硼酸(H3BO3)是生产其它硼化物的基本原料。已知H3BO3的电离常数为5.8×10-10,H2CO3的电离常数为K1=4.4×10-7、K2=4.7×10-11。向盛有饱和硼酸溶液的试管中,滴加0.1 mol/LNa2CO3溶液, (填“能”或“不能”)观察到气泡逸出。已知H3BO3与足量NaOH溶液反应的离子方程式为H3BO3+OH-=B(OH)4-,写出硼酸在水溶液中的电离方程式 。
Ⅲ、某温度时,测得0.01 mol/L的NaOH溶液pH为11,求该温度下水的离子积常数Kw
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com