
【题目】某化学学习小组在实验室模拟工业法制取Br2,装置如图所示。
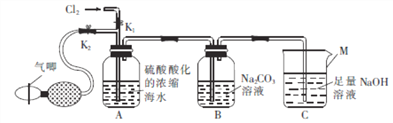
(1)仪器M的名称是 ____________。
(2)实验室制取的Cl2在通入装置A之前 ______(填“需要”或“不需要”)除杂。
(3)实验前检查装置气密性的方法是 __________。
(4)反应过程中,Br2在装置B中与Na2CO3反应生成NaBrO3 ______。为使装置A中产生的Br尽可能被吸收,可采取的合理措施是
(5)反应结束后,取下装置B,向装置B中加入稀H2SO4会生成Br2,该反应的离子方程式为_________。
【答案】 烧杯 不需要 关闭K1,打开K2,在烧杯C中加入适量的水,将导管末端浸入水中,缓慢鼓动气唧,观察导管末端有没有气泡产生 通过气唧缓慢鼓入空气 6H++5Br-+BrO3-=3NR2+3H2O
【解析】(1)根据装置图,仪器M是烧杯;
(2)实验室制取的Cl2中含有氯化氢和水蒸气,氯化氢和水蒸气对实验无影响,在通入装置A之前不需要除杂;
(3)实验前检查装置气密性的方法是关闭K1,打开K2,在烧杯C中加入适量的水,将导管末端浸入水中,缓慢鼓动气唧,观察导管末端有没有气泡产生;
(4)溴容易挥发,为使装置A中产生的Br2尽可能被吸收,可采取的合理措施是通过气唧缓慢鼓入空气;
(5)向装置B中加入稀H2SO4,NaBr和NaBrO3发生氧化还原反应生成Br2,反应的离子方程式为6H++5Br-+BrO3-=3NR2+3H2O。


科目:高中化学 来源: 题型:
【题目】砹(At)是卤族元素中位于碘后的元素,推测砹和砹的化合物最不可能具备的性质是( )
A. 砹易溶于某些有机溶剂 B. 砹化氢很稳定不易分解
C. 砹是有色固体 D. 砹化银不溶于水或稀硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胡椒乙酸是合成许多药用生物碱的重要中间体,以苯酚为原料制备胡椒乙酸的合成路线如图所示。
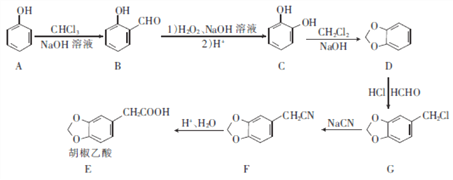
回答下列问题:
(1)下列关于有机物B的说法正确的是 ____________(填字母)。
a.能与FeCl3溶液发生显色反应
b.核磁共振氢谱中只有3组峰
c.能发生银镜反应
d.能与溴水发生加成反应
(2)C的名称是___________,C D的反应类型是_______。
(3)胡椒乙酸(E)中所含官能团的名称为 __________ 。
(4)G生成F的化学方程式为_____________。
(5)W是E的同分异构体,0.5 mol W与足量碳酸氢钠溶液反应生成1 mol C02,已知W的苯环上只有2个取代基,则W的结构共有__________(不含立体异构)种,其中核磁共振氢谱有五组峰的结构简式为_______。
(6)参照上述合成路线,写出以一氯甲苯(![]() )为原料(无机试剂任选)制备苯乙酸的合成路线:____________________
)为原料(无机试剂任选)制备苯乙酸的合成路线:____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O(笑气)、CHCl3(氯仿)都曾在医学上被用作麻醉剂。下列说法正确的是
A. N2O、CHCl3都易溶于水 B. N2O、CHCl3都常温下都是气体
C. N2O、CHCl3都属于弱电解质 D. N2O、CHCl3都是非电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2H2(g)+O2(g)=2H2O(g) △H=-484kJ/mol。且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H-O键形成时放出热量463 kJ,则氢气中1 mol H-H键断裂时吸收热量为( )
A.920 kJB.557 kJC.436 kJD.188 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学反应与能量变化的说法正确的是
A. 放热反应的发生无需任何条件 B. 化学键的断裂和形成与反应放热和吸热无关
C. 化学反应过程都伴随着能量的变化 D. H2SO4与NaOH的反应是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家构建了一种双微生物燃料电池,以苯酚(QH60)为燃料,同时消除酸性废水中的硝酸盐。下列说法正确的是:( )
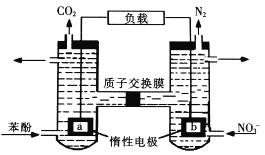
A. a为正极
B. 若右池产生0. 672L气体(标况下),则转移电子0.15mol
C. 左池电极反应式为 C6H6O+11H2O-28e-=6CO2↑+28H+
D. 左池消耗的苯酚与右池消耗的的物质的量之比为別28:5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚锡(SnSO4)是一种重要的硫酸盐,广泛应用于镀锡工业。某研究小组设计SnSO4制备路线如下:
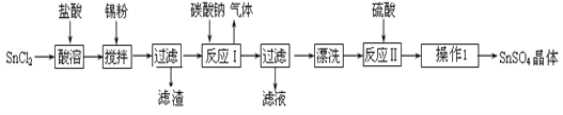
查阅资料:
Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnCl2易水解生成碱式氯化亚锡,Sn相对原子质量为119。
回答下列问题:
(1) 操作Ⅰ是________________、过滤洗涤。
(2)SnCl2粉末需加浓盐酸进行溶解的原因_______________________。
(3)加入Sn粉的作用有两个:①调节溶液pH,②_______________。
(4)反应Ⅰ得到沉淀是SnO,得到该沉淀的离子反应方程式是______________。
(5)酸性条件下,SnSO4还可以用作双氧水去除剂,发生反应的离子方程式是________________。
(6)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):
①将试样溶于盐酸中,发生的反应为:Sn + 2HCl![]() SnCl2+ H2↑;
SnCl2+ H2↑;
②加入过量的FeCl3;
③用已知浓度的K2Cr2O7滴定生成的Fe2+,发生的反应为:6FeCl2+ K2Cr2O7+ 14HCl![]() 6FeCl3+ 2KCl + 2CrCl3+7H2O
6FeCl3+ 2KCl + 2CrCl3+7H2O
现取0.80 g锡粉,经上述各步反应后,共用去0.1000 mol/L K2Cr2O7溶液20.00mL。则锡粉中锡的纯度为_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com