
下列各组离子,能在溶液中大量共存的是
A. Na+ 、Mg2+ 、Cl- 、SO42- B. Na+ 、Ca2+ 、CO32- 、NO3-
C. Na+ 、H+ 、Cl- 、CO32- D. K+ 、Al3+ 、SO42- 、OH-
科目:高中化学 来源:2017届天津市红桥区高三上学期期末考试(下学期开学考试)化学试卷(解析版) 题型:选择题
T℃时,在一固定容积的密闭容器中发生反应:A(g)+B(g) C(s) △H<0,按照不同配比充入A、B,达到平衡时容器中A、B浓度变化如图中曲线(实线)所示,下列判断正确的是
C(s) △H<0,按照不同配比充入A、B,达到平衡时容器中A、B浓度变化如图中曲线(实线)所示,下列判断正确的是
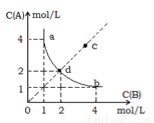
A. T ℃ 时,该反应的平衡常数值为4
B. c点没有达到平衡,此时反应向逆向进行
C. 若c点为平衡点,则此时容器内的温度高于T ℃
D. T℃时,直线cd 上的点均为平衡状态
查看答案和解析>>
科目:高中化学 来源:2017届江苏省联盟大联考高三2月联考化学试卷(解析版) 题型:简答题
K3[Fe(C2O4)3](三草酸合铁酸钾)可用于摄影和蓝色印刷。工业上以H2C2O4(草酸)、FeC2O4(草酸亚铁)、K2C2O4(草酸钾)、双氧水等为原料制备K3[Fe(C2O4)3]的反应原理如下:
氧化:6FeC2O4+3H2O2+6K2C2O4═4K3[Fe(C2O4)3]+2Fe(OH)3
转化:2Fe(OH)3+3K2C2O4+3H2C2O4═2K3[Fe(C2O4)3]+6H2O
(1)制备1mol 三草酸合铁酸钾至少需要H2O2的物质的量为____________。
(2)制备过程中需防止草酸被H2O2氧化,写出草酸被H2O2氧化的化学方程式:______________。
(3)[K3[Fe(C2O4)3·xH2O](三草酸合铁酸钾晶体)是一种光敏材料,为测定该晶体中草酸根的含量和结晶水的含量,某实验小组进行了如下实验:
①称量9.820g三草酸合铁酸钾晶体,配制成250mL溶液.
②取所配溶液25.00mL于锥形瓶中,滴加KMnO4溶液至C2O42-全部转化成CO2时,恰好消耗24.00mL 0.1000mol/L KMnO4溶液。
计算该晶体的化学式,并写出计算过程______________。
查看答案和解析>>
科目:高中化学 来源:2017届江苏省联盟大联考高三2月联考化学试卷(解析版) 题型:选择题
2016年中国环境日的主题为“改善环境质量,推动绿色发展”,旨在保护环境造福人类。下列说法不正确的是
A. 通过植树造林,可吸收二氧化碳,降低温室效应
B. 使用含硫量大幅减少的国V汽油可降低酸雨发生
C. 开发新能源,减少使用化石燃料,可以减少雾霾的发生
D. 汽车尾气经催化处理,可消除氮元素,避免光化学烟雾
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省六校协作体高一下学期期初化学试卷(解析版) 题型:选择题
用如图所示装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加
入的试剂),其中可行的是

气体 | a | b | c | |
A | NO2 | 浓硝酸 | 铜片 | 浓硫酸 |
B | SO2 | 浓硫酸 | Fe | 浓硫酸 |
C | NH3 | 浓氨水 | 生石灰 | 碱石灰 |
D | Cl2 | 浓盐酸 | MnO2粉末 | 浓硫酸 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省六校协作体高一下学期期初化学试卷(解析版) 题型:选择题
下面关于硅的叙述中,正确的是
A. 硅是亲氧元素,在自然界中以化合态存在
B. 硅是构成矿物和岩石的主要元素,硅在地壳中的含量在所有元素中居第一位
C. 硅的活泼性比碳强,只有在高温下才能跟氢气起化合反应
D. 二氧化硅在电子工业中,是重要的半导体材料
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省南昌市高二上学期期末考试化学试卷(解析版) 题型:简答题
(Ⅰ)部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HClO | H2CO3 | H2SO3 |
电离平衡常数(25 ℃) | Ka=1.77 ×10-4 | Ka=4.0 ×10-8 | Ka1=4.3×10-7 Ka2=4.7×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
(1)室温下①0.1 mol·L-1 HCOONa,②0.1 mol·L-1 NaClO,③0.1 mol·L-1 Na2CO3,④0.1 mol·L-1 NaHCO3溶液的pH由大到小的关系为______________________。
(2)浓度均为0.1 mol·L-1的Na2SO3和Na2CO3的混合溶液中,SO32-、CO32-、HSO3-、HCO3-浓度从大到小的顺序为____________________。
(3)少量CO2通入到过量的NaClO溶液中发生反应的离子方程式______________。
(4)常温下,pH=3的HCOOH溶液与pH=11的NaOH溶液等体积混合后,溶液中离子浓度由大到小的顺序为__________________。
(Ⅱ)某小组运用工业上离子交换膜法制烧碱的原理,用如下图所示装置电解K2SO4溶液。
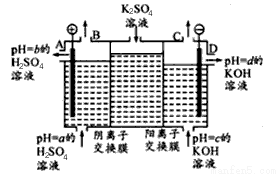
①该电解槽中通过阴离子交换膜的离子数_______(填“>”“<”或“一”)通过阳离子交换膜的离子数;
②图中a、b、c、d分别表示有关溶液的pH,则a、b、c、d由小到大的顺序为 _____________;
③电解一段时间后,B出口与C出口产生气体的质量比为______________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省南昌市高二上学期期末考试化学试卷(解析版) 题型:选择题
将4molA气体和2molB气体在2 L的容器中混合,并在一定条件下发生如下反应:2A(g)+B(g)  2C(g)。若经2 s后测得C的浓度为0.6mol·L-1,现有下列几种说法:
2C(g)。若经2 s后测得C的浓度为0.6mol·L-1,现有下列几种说法:
①用物质A表示的反应的平均速率为0.3 mol·L-1·s-1 ;
②用物质B表示的反应的平均速率为0.6 mol·L-1·s-1;
③2s时物质A的转化率为30% ;
④2s时物质B的浓度为1.4mol·L-1。
其中正确的是( )
A. ①③ B. ①④ C. ②③ D. ③④
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省高一下学期开学考试化学试卷(解析版) 题型:选择题
下列反应的离子方程式正确的是
A. 用小苏打(NaHCO3)治疗胃酸(HCl)过多:CO32-+2H+ =CO2↑+H2O
B. 氯化铁溶液腐蚀铜箔制印刷线路板:Fe3++Cu=Fe2++ Cu2+
C. 氢氧化镁溶于盐酸:Mg(OH)2+2H+= Mg2++2H2O
D. Fe3+与I-反应的离子方程式为:Fe3++2I-= Fe2++ I2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com