
| A. | ①③④ | B. | ②⑤⑥ | C. | ③⑤ | D. | ③④⑤ |
分析 ①等物质量的盐酸和醋酸消耗镁的质量相同,而pH=3,则c(CH3COOH)>c(HCl),由此分析解答;
②Na2CO3溶液是强碱弱酸盐,水解呈碱性,CO32-+H2O?HCO3-+OH-,溶液中的氢氧根离子由自于水的电离,水电离产生的氢离子与氢氧根离子的浓度相等,由此分析解答;
③根据同浓度时的碱性强弱比较;
④根据电荷守恒判断;
⑤加水稀释,促进醋酸电离,但氢离子浓度减小,醋酸浓度也减小,$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$的分子和分母同乘以醋酸根离子的浓度,然后分析解答;
⑥如HA为强酸,则V1=V2,如HA为弱酸,HA的浓度较大.
解答 解:①等物质量的盐酸和醋酸消耗镁的质量相同,而pH=3,则c(CH3COOH)>c(HCl),所以等体积的盐酸和醋酸分别与足量镁粉反应,醋酸消耗镁的量大,故错误;
②Na2CO3溶液是强碱弱酸盐,水解呈碱性,CO32-+H2O?HCO3-+OH-,溶液中的氢氧根离子由自于水的电离,水电离产生的氢离子与氢氧根离子的浓度相等,因为pH=10,所以c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-10}}$=10-4mol/L,所以水电离出的c(H+)为10-4mol/L,故B错误;
③四种盐的水溶液均显碱性,同浓度,碱性强弱顺序为d>b>c>a,故pH相等的四种溶液物质的量浓度由小到大顺序为d、b、c、a,故正确;
④pH=7,c(H+)=c(OH-),由电荷守恒可知,溶液中应存在c(Na+)+c(NH4+)=2c(SO42-),故错误;
⑤加水稀释,促进醋酸电离,但氢离子浓度减小,醋酸根离子浓度也减小,$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$的分子和分母同乘以醋酸根离子的浓度,即$\frac{{K}_{a}}{c(C{H}_{3}CO{O}^{-})}$,分母减小,所以比值增大,故正确;
⑥如HA为强酸,则V1=V2,如HA为弱酸,HA的浓度较大,则V1>V2,故错误;
故选C.
点评 本题以电解质的电离为载体考查了电解质的电离、盐类的水解以及难溶电解质的溶解平衡、pH的计算等知识点,注意根据电解质的电离特点结合电荷守恒来分析解答,题目难度中等.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:选择题
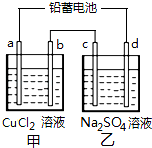 用铅蓄电池电解甲、乙电解池中的溶液.已知铅蓄电池的总反应为:Pb+PbO2+2H2SO4═2PbSO4+2H2O,电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是( )
用铅蓄电池电解甲、乙电解池中的溶液.已知铅蓄电池的总反应为:Pb+PbO2+2H2SO4═2PbSO4+2H2O,电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是( )| A. | d极为阴极 | |
| B. | 放电时铅蓄电池负极的电极反应式为:PbO2+4H++SO42-+4e-═PbSO4+2H2O | |
| C. | 若利用甲池精炼铜,b极应为粗铜 | |
| D. | 若电极材料均为石墨,当析出6.4g Cu时,两池共产生气体3.36L(标准状况下) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.0176 | B. | 0.1600 | C. | 0.1200 | D. | 0.2400 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.
实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④②①③ | B. | ①④③② | C. | ②③①④ | D. | ②④①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S2- | B. | S | C. | SO42- | D. | SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
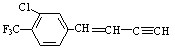 分子的下列叙述中,错误的是( )
分子的下列叙述中,错误的是( )| A. | 该物质使酸性高锰酸钾溶液褪色 | |
| B. | 一分子该物质能与6分子H2加成 | |
| C. | 最多有18个原子可能处在同一平面上 | |
| D. | 分子式为C11H6ClF3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
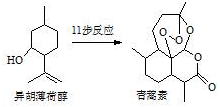 2015年我国药物化学家屠吆吆因发明抗疟疾新药青蒿素和双氢青蒿素被授予诺贝尔生理学或医学奖.以异胡薄荷醇为起始原料是人工合成青蒿素的途径之一(如图).下列说法正确的是( )
2015年我国药物化学家屠吆吆因发明抗疟疾新药青蒿素和双氢青蒿素被授予诺贝尔生理学或医学奖.以异胡薄荷醇为起始原料是人工合成青蒿素的途径之一(如图).下列说法正确的是( )| A. | 异胡薄荷醇遇FeCl3溶液显紫色 | |
| B. | 异胡薄荷醇可发生消去反应、加成反应 | |
| C. | 青蒿素分子中含有5个手性碳原子 | |
| D. | 青蒿素在热的酸、碱溶液中均可稳定存在 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com