
| 编号 | 物质(微粒) | 电离度α | ||||
| A | 硫酸溶液(第一步完全电离):第二步 HSO
|
10% | ||||
| B | 硫酸氢钠溶液:HSO
|
29% | ||||
| C | 醋酸:CH3COOH?CH3COO-+H+ | 1.33% | ||||
| D | 盐酸:HCl=H++Cl- | 100% |
- 4 |
- 4 |
| c(CH3COO-)?c(H+) |
| c(CH3COOH) |
| c(CH3COO-)?c(H+) |
| c(CH3COOH) |
| c(CH3COO-)?c(H+) |
| c(CH3COOH) |
| cα×cα |
| c-cα |
| cα2 |
| 1-α |
| c(CH3COO-)?c(H+) |
| c(CH3COOH) |
| cα2 |
| 1-α |


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:
| 步骤 | 现象 |
| ⅰ.向盛有30mL 0.2mol?L-1 KI溶液的锥形瓶中依次滴入几滴淀粉溶液和足量稀硫酸,再用滴定管逐滴加入KBrO3溶液 | 随着KBrO3溶液滴入,溶液由无色变为蓝色并逐渐加深,最终保持不变 |
| ⅱ.继续向上述溶液中滴入KBrO3溶液 | 溶液的蓝色逐渐褪去 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
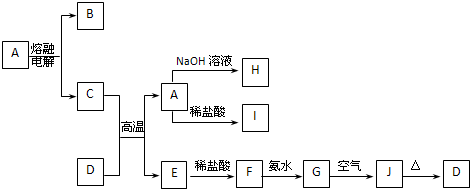
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
| 原子半径(10-10m) | 1.86 | 1.52 | 0.66 | 1.43 | 0.77 | 1.10 | 0.99 | 2.31 | 0.70 | 0.64 |
| 最高价态 | +1 | +1 | - | +3 | +4 | +5 | +7 | +1 | +5 | - |
| 最低价态 | - | - | -2 | - | -4 | -3 | -1 | - | -3 | -1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将1mol?L-1 FeCl3溶液滴入沸水中制备Fe(OH)3胶体 |
| B、氢气还原氧化铜实验中,先通氢气后加热氧化铜 |
| C、将FeCl3稀溶液加热蒸发浓缩制备FeCl3浓溶液 |
| D、用烧瓶加热液体时投入碎瓷片以防暴沸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com