
��14�֣���ͼ���dz��������巢��װ�ã�IV��V��VI�������ռ�װ�ã�����Ҫ�������������⣺
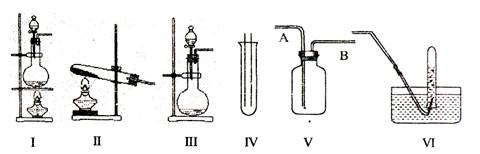
��1�����巢��װ�õ�ѡ������CaCO3�����ᷴӦ��CO2,���ѡ�� ��������ţ�
����NH4Cl��Ca(OH)2��Ӧ��NH3�����ѡ�� ��������ţ�
����MnO2��Ũ���ᷴӦ��ȡ������Ӧѡ��װ�� ��������ţ�
�����ӷ���ʽ��ʾ��ȡ�����ķ�Ӧԭ���� ��
��2���ռ�װ�õ�ѡ����ѡ��VΪ�����ռ�װ�ã�������Ӧ�� ��ͨ�롣�û�ѧ�������������ռ����ķ����� ��
��3����������գ��������鷢�֣���1�����ˮ������336�����HCl���ҵõ�����Һ���ܶ�Ϊ1.08g/cm3,��������Һ�����ʵ����ʵ���Ũ��Ϊ mol/L��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
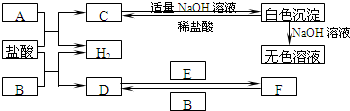
 ��2009?��������ͼ��ʾ�й����ʣ����ɶ�����Ԫ���γɣ�֮���ת����ϵ������AΪ�����Ľ������ʣ�BΪ�ǽ������ʣ�һ���Ǻ�ɫ��ĩ����C�dz�������ɫ��ζҺ�壬D�ǵ���ɫ�Ĺ��廯�������Ӧ����ͼ����ʡ�ԣ���
��2009?��������ͼ��ʾ�й����ʣ����ɶ�����Ԫ���γɣ�֮���ת����ϵ������AΪ�����Ľ������ʣ�BΪ�ǽ������ʣ�һ���Ǻ�ɫ��ĩ����C�dz�������ɫ��ζҺ�壬D�ǵ���ɫ�Ĺ��廯�������Ӧ����ͼ����ʡ�ԣ����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�





�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com