
某实验小组对一含有Al3+的未知溶液进行分析:往该溶液逐滴滴加某浓度NaOH溶液,所加NaOH溶液体积(ml)与产生沉淀的物质的量(mol)的关系如下图所示:下列说法错误的是( )

A.该未知溶液中至少含有3种阳离子
B.滴加的NaOH溶液的物质的量浓度为5 mol•L﹣1
C.若将最终沉淀过滤、洗涤、灼烧,其质量一定为6 g
D.若溶液中仅有两种金属阳离子,且另一种离子为二价阳离子,则a=10
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2016-2017学年山东省济南市高二上第一次质检化学卷(解析版) 题型:选择题
下列关于电化学的实验事实正确的是( )
出现环境 | 实验事实 | |
A | 以稀H2SO4为电解质的Cu-Zn原电池 | Cu为正极,正极上发生还原反应 |
B | 电解CuCl2溶液 | 电子 |
C | 弱酸性环境下钢铁腐蚀 | 负极处产生H2,正极处吸收O2 |
D | 将钢闸门与外加电源负极相连 | 牺牲阳极阴极保护法,可防止钢闸门腐蚀 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年内蒙古高一上月考一化学卷(解析版) 题型:选择题
设NA为阿伏伽德罗常数的值,下列说法正确的是 ( )
A.在常温常压下,1 mol Ne含有的原子数为NA
B.在25 ℃、1.01×105 Pa时,11.2 L N2所含的原子数为NA
C.18g水中所 含的质子数为8NA
含的质子数为8NA
D.在同温同压下,相同体积的任何气体单质所含的原子数相同
查看答案和解析>>
科目:高中化学 来源:2017届广东省惠州市高三上学期调研模拟二化学试卷(解析版) 题型:简答题
运用化学反应原理知识研究如何利用CO、SO2等污染物有重要意义。
(1)用CO可以合成甲醇。已知:
CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(l) ΔH1kJ·mol-1
CO(g)+1/2O2(g)=CO2(g) ΔH2kJ·mol-1
H2(g)+1/2O2(g)=H2O(l) ΔH3kJ·mol-1
则CO(g)+2H2(g) CH3OH(g) ΔH =_______kJ·mol-1。
CH3OH(g) ΔH =_______kJ·mol-1。
(2)一定压强下,在容积为2 L的密闭容器中充入1mol CO与2 mol H2,在催化剂作用下发生反应:CO(g)+2H2(g)  CH3OH(g) ΔH ,平衡转化率与温度、压强的关系如图所示。
CH3OH(g) ΔH ,平衡转化率与温度、压强的关系如图所示。

① 下列说法正确的是____________
A.若容器内气体密度恒定,反应达到平衡状态
B.若容器内各气体浓度恒定,反应达到平衡状态
C.上述反应中,ΔH > 0
D.反应中,催化剂使平衡向正反应方向移动
② p2 p1 (填“大于”、“小于”或“等于”);
③ 100 ℃时,该反应的化学平衡常数K=____ ____;
(3)某科研小组用SO2为原料制取硫酸。
① 利用原电池原理,用SO2、O2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触。请写出该电池负极的电极反应式:___________________。
② 用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸。电解原理示意图如下。请写出开始时阳极反应的电极反应式____________________________。

查看答案和解析>>
科目:高中化学 来源:2017届广东省惠州市高三上学期调研模拟二化学试卷(解析版) 题型:选择题
在一定条件下,等物质的量的氯气与碘单质反应,得到一种红棕色液体ICl,ICl有很强的氧化性。现有下列两个反应:①2ICl+2Zn=ZnCl2+ZnI2;②ICl+H2O=HCl+HIO,下列叙述正确的是
A.Cl2与I2生成ICl是非氧化还原反应
B.反应①中,每生成1 mol ZnCl2时转移2mol电子
C.反应①中,ZnI2既是氧化产物又是还原产物
D.反应②中,ICl既是氧化剂又是还原剂
查看答案和解析>>
科目:高中化学 来源:2017届福建省龙岩市五校高三上学期期中化学试卷(解析版) 题型:选择题
FeCO3与砂糖混用可以作补血剂,实验室里制备FeCO3的流程如图所示.下列说法错误的是( )

A.产品FeCO3在空气中高温分解可得到纯净的FeO
B.可利用KSCN溶液检验FeSO4溶液是否变质
C. 沉淀过程中有CO2气体放出
沉淀过程中有CO2气体放出
D.检验沉淀是否洗涤干净可用盐酸酸化的BaCl2溶液
查看答案和解析>>
科目:高中化学 来源:2017届福建省龙岩市五校高三上学期期中化学试卷(解析版) 题型:选择题
设NA代表阿伏加德罗常数的数值,下列说法中正确的是( )
A.常温常压下,18 g重水(D2O)所含的中子数为10NA
B.100℃时,1L pH=1的硫酸溶液中,含有0.2NA个H+
C.71g氯气发生氧化还原反应,一定失去2NA个电子
D.室温下,14gN2和CO的混合气体中含有的原子数目为NA
查看答案和解析>>
科目:高中化学 来源:2017届北京市高三上学期期中化学试卷(解析版) 题型:选择题
纸电池是一种有广泛应用的“软电池”,右图这种碱性纸电池采用薄层纸片作为载体和传导体,纸的两面分别附着锌和二氧化锰。下列有关该纸电池说法不合理的是
A.Zn为负极,进行氧化反应
B.电池工作时,电子由MnO2流向Zn
C.正极反应:MnO2+e-+H2O=MnO(OH)+OH—
D.电池总反应:Zn+2MnO2+2H2O=Zn(OH)2+2MnO(OH)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二10月月考化学卷(解析版) 题型:选择题
50mL 0.5mol·L-1盐酸与50mL 0.55mol·L-1 NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
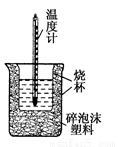
(1)从实验装置上看,图中尚缺少一种玻璃仪器是__________。
(2)大烧杯上如不盖硬纸板,测得的中和热________(填“偏大”或“偏小”或“无影响”)。
(3)实验中改用60mL 0.50mol·L-1盐酸跟50mL 0.50mol·L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量________(填“偏大”或“相等”或“偏小”),所求中和热________(填“相等”或“不相等”),简述理由:_________________________。
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会________;用50mL 0.5mol·L-1盐酸与50mL 0.50mol·L-1 NaOH溶液进行中和测定,测得的中和热数值会________。(填“偏大”、“偏小”或“无影响”)
(5)取50 mL 0.50 mol/L NaOH溶液和30 mL0.50 mol/L硫酸溶液进行实验,实验数据如下表。

则中和热ΔH= (取小数点后一位)。(本题中NaOH溶液和硫酸溶液的密度均取1g/mL,溶液的比热容均取4.2J/(g.℃))
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com