
| A. | +92 | B. | -345.3 | C. | -92 | D. | +345.3 |
科目:高中化学 来源: 题型:选择题
| A. | 25℃,1.01×l05Pa,46gNO2中含有的分子数等于NA | |
| B. | 7.8gNa2O2含有的阴离子数目为0.2NA | |
| C. | 2.0g重水(D2O)中含有的质子数和中子数均为NA | |
| D. | 标况下,1.12LC12溶于水,转移0.05NA电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 实验室可用Na2SO3与浓H2SO4反应制备SO2 | |
| B. | 用澄清石灰水可鉴别CO2和SO2 | |
| C. | Na2SO3长期放置空气中容易变质 | |
| D. | SO2通入BaCl2溶液中能产生白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
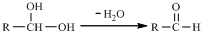 .请根据图回答:
.请根据图回答:
 .
. ; ②CH3CHO+2Cu(OH)2$\stackrel{△}{→}$CH3COOH+Cu2O↓+2H2O.
; ②CH3CHO+2Cu(OH)2$\stackrel{△}{→}$CH3COOH+Cu2O↓+2H2O.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C14H18O5 | B. | C14H22O3 | C. | C14H22O5 | D. | C14H10O5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.4g金属镁所含电子数目为0.2NA | B. | 16gCH4所含原子数目为NA | ||
| C. | 17g NH3所含质子数为10 NA | D. | 18g水所含分子数目为18NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
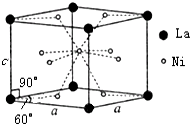 材料的开发、应用和发展是科技进步的结果,同时,材料的发展也促进了科技的进步和发展.
材料的开发、应用和发展是科技进步的结果,同时,材料的发展也促进了科技的进步和发展.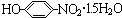 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
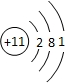 ,Y
,Y ,Z
,Z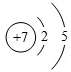 ,W
,W .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
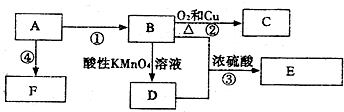
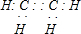 ,C的名称乙醛,
,C的名称乙醛,查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com