
用NA表示阿伏德罗常数,下列叙述正确的是
A.标准状况下,22.4LH2O含有的分子数为NA
B.常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA
C.通常状况下, NA 个CO2分子占有的体积为22.4L
D.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为NA
科目:高中化学 来源:2016-2017学年江苏省高一下学期第一次(3月)阶段检测化学试卷(解析版) 题型:填空题
请回答氯碱工业中的如下问题:
(1)氯气、烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品。理论上k= (要求写出计算表达式和结果);
(2)原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)、③BaCl2,这3种试剂添加的合理顺序是 (填序号);
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
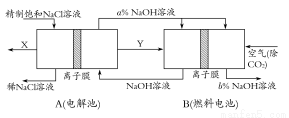
①图中X、Y分别是 、 (填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小 ;
②分别写出燃料电池B中正极、负极上发生的电极反应,正极: ;负极: ;
③这样设计的主要节(电)能之处在于(写出2处) 、 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年贵州省高二开学质检(3月)化学试卷(解析版) 题型:简答题
(1)Na2CO3溶液中滴加酚酞呈红色,原因是____________________(用离子方程式表示)。加热后颜色变________(填“深”或“浅”),0.1mol/L Na2CO3溶液和,0.1mol/L NaHCO3溶液比较,水的电离程度前者________后者(填“>”“等于”或“<”)。

(2)已知H2O2是一种弱酸,在强碱性溶液中主要以HO2-形式存在。目前研究比较热门的Al-H2O2电池,其电池总反应为2Al+3HO2-=2AlO2-+OH-+H2O。现以Al—H2O2电池电解尿素的碱性溶液制备氢气,尿素的结构简式为:(右池中隔膜仅阻止气体通过,b、c、d均为惰性电极)。试回答下列问题:

①右池是____________池;
②电极b是_______极,其电极反应式为__________________。
③通电2min后,Al电极质量减轻2.7g,则产生N2的体积为__________(标准状况)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年贵州省高一(3月)开学质检化学试卷(解析版) 题型:选择题
X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示。已知Y原子的最外层电子数是次外层的3倍。下列叙述正确的是

A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:Z>W>X
C. Y单质的沸点比Z单质的沸点高
D. W单质跟水反应形成的溶液具有漂白性
查看答案和解析>>
科目:高中化学 来源:2016-2017学年贵州省高一(3月)开学质检化学试卷(解析版) 题型:选择题
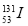 是常规核裂变产物之一,可以通过测定大气或水中
是常规核裂变产物之一,可以通过测定大气或水中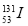 的含量变化来监测核电站是否发生放射性物质泄漏。下列有关
的含量变化来监测核电站是否发生放射性物质泄漏。下列有关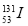 的叙述中错误的是
的叙述中错误的是
A. 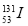 的化学性质与
的化学性质与 相同 B.
相同 B. 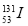 的原子序数为53
的原子序数为53
C. 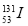 的原子核外电子数为78 D.
的原子核外电子数为78 D. 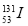 的原子核内中子数多于质子数
的原子核内中子数多于质子数
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三3月联考理科综合化学试卷(解析版) 题型:简答题
雾霾天气频繁出现,严重影响人们的生活和健康。其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。
若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
浓度mol/L | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断试样的pH=_________。
(2)汽车尾气中NOx和CO的生成:
①已知汽缸中生成NO的反应为:N2(g)+O2(g) 2NO(g) △H>0恒温,恒容密闭容器中,下列说法中能说明该反应达到化学平衡状态的是____
2NO(g) △H>0恒温,恒容密闭容器中,下列说法中能说明该反应达到化学平衡状态的是____
A.混合气体的密度不再变化 B.混合气体的平均分子量不再变化
C.N2、O2、NO的物质的量之比为1∶1∶2 D.氧气的百分含量不再变化
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO,2CO(g)=2C(s)+O2(g),已知该反应的△H>0,则该设想能否实现______________(填“能”或“不能”)
(3)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。已知:
H2(g)+ 1/2O2(g) =H2O(g) △H=-241.8kJ·mol-1
C(s)+1/2O2(g) =CO(g)△H =-110.5kJ·mol-1
写出焦炭与水蒸气反应的热化学方程式:___________________。
②洗涤含SO2的烟气。
(4)汽车尾气净化的主要原理:2NO(g)+2CO(g) 2CO2(g)+N2(g);△H<0,若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是_________(填序号)。(如图中v正、K、n、w分别表示正反应速率、平衡常数、物质的量、质量分数)
2CO2(g)+N2(g);△H<0,若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是_________(填序号)。(如图中v正、K、n、w分别表示正反应速率、平衡常数、物质的量、质量分数)

车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”之一。活性炭可处理大气污染物NO。在5L密闭容器中加入NO和活性炭(假设无杂质)。一定条件下生成气体E和F。当温度分别在T1℃和T2℃时,测得各物质平衡时物质的量(n/mol)如下表:
物质 温度/℃ | 活性炭 | NO | E | F |
初始 | 3.000 | 0.10 | 0 | 0 |
T1 | 2.960 | 0.020 | 0.040 | 0.040 |
T2 | 2.975 | 0.050 | 0.025 | 0.025 |
(1)写出NO与活性炭反应的化学方程式______________________;
(2)计算上述反应T1℃时的平衡常数K1=__________________;若T1<T2,则该反应的△H__________________0(填“>”、“<”或“=”)。
(3)上述反应T1℃时达到化学平衡后再通入0.1molNO气体,则达到新化学平衡时NO的转化率为________;
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省鞍山市高三3月月考理科综合化学试卷(解析版) 题型:选择题
对下列各有机物同分异构体数目(不考虑立体异构)的判断中正确的是
A. 分子式为C4H8,能发生加成反应的同分异构体有2种
B. 分子式为C8H10的二甲苯,苯环上.的一个氢原子被溴原子取代,所得产物有6种
C. 分子式为C4H8Cl2,只有一个甲基的同分异构体有5种
D. 分子式为C5H10O2,只有一个官能团,且能溶于水的同分异构体有2种
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二3月月考化学试卷(解析版) 题型:选择题
用情性电极电解一定浓度的CuSO4溶液,通电—段时间后,向所得的溶液中加入9.8g Cu(OH)2后恰好恢复到电解前的浓度和pH。则下列说法正确的是
A. 电解过程中阴极没有气体生成
B. 电解过程中阳极收集到的气体体枳为1.12L(标况下)
C. 原CuSO4溶液的浓度为0.1 mol·L-1
D. 电解过程中转移的电子的物质的量为0.4mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com