
某温度下,0.01mol/L NaOH的pH为10,该温度下将pH=5的强酸溶液和pH=8的强碱溶液混合后pH=7,则酸溶液体积和碱溶液体积比为( )
A. 1:10 B. 10:1 C. 9:2 D. 2:9
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源:2016-2017学年安徽省宿州市高一上学期期末教学质量检测(a卷)化学试卷(解析版) 题型:选择题
下列实验操作或装置能达到实验目的的是
A.  量取109.3ml稀盐酸 B.
量取109.3ml稀盐酸 B. 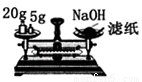 称量25g烧碱固体
称量25g烧碱固体
C. 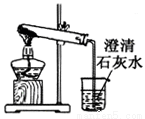 碳酸氢钠受热分解 D.
碳酸氢钠受热分解 D.  配制一定物质的量浓度的稀硫酸
配制一定物质的量浓度的稀硫酸
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省六校协作体高一下学期期初化学试卷(解析版) 题型:选择题
用如图所示装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加
入的试剂),其中可行的是

气体 | a | b | c | |
A | NO2 | 浓硝酸 | 铜片 | 浓硫酸 |
B | SO2 | 浓硫酸 | Fe | 浓硫酸 |
C | NH3 | 浓氨水 | 生石灰 | 碱石灰 |
D | Cl2 | 浓盐酸 | MnO2粉末 | 浓硫酸 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省南昌市高二上学期期末考试化学试卷(解析版) 题型:简答题
(Ⅰ)部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HClO | H2CO3 | H2SO3 |
电离平衡常数(25 ℃) | Ka=1.77 ×10-4 | Ka=4.0 ×10-8 | Ka1=4.3×10-7 Ka2=4.7×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
(1)室温下①0.1 mol·L-1 HCOONa,②0.1 mol·L-1 NaClO,③0.1 mol·L-1 Na2CO3,④0.1 mol·L-1 NaHCO3溶液的pH由大到小的关系为______________________。
(2)浓度均为0.1 mol·L-1的Na2SO3和Na2CO3的混合溶液中,SO32-、CO32-、HSO3-、HCO3-浓度从大到小的顺序为____________________。
(3)少量CO2通入到过量的NaClO溶液中发生反应的离子方程式______________。
(4)常温下,pH=3的HCOOH溶液与pH=11的NaOH溶液等体积混合后,溶液中离子浓度由大到小的顺序为__________________。
(Ⅱ)某小组运用工业上离子交换膜法制烧碱的原理,用如下图所示装置电解K2SO4溶液。
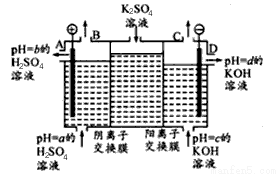
①该电解槽中通过阴离子交换膜的离子数_______(填“>”“<”或“一”)通过阳离子交换膜的离子数;
②图中a、b、c、d分别表示有关溶液的pH,则a、b、c、d由小到大的顺序为 _____________;
③电解一段时间后,B出口与C出口产生气体的质量比为______________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省南昌市高二上学期期末考试化学试卷(解析版) 题型:选择题
室温下向10 mL 0.1 mol·L-1NaOH溶液中加入0.1 mol·L-1的一元酸HA,溶液pH的变化曲线如图所示。下列说法正确的是( )
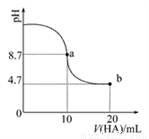
A. a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA)
B. a、b两点所示溶液中水的电离程度相同
C. pH=7时,c(Na+)=c(A-)+c(HA)
D. b点所示溶液中c(A-)>c(HA)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省南昌市高二上学期期末考试化学试卷(解析版) 题型:选择题
将4molA气体和2molB气体在2 L的容器中混合,并在一定条件下发生如下反应:2A(g)+B(g)  2C(g)。若经2 s后测得C的浓度为0.6mol·L-1,现有下列几种说法:
2C(g)。若经2 s后测得C的浓度为0.6mol·L-1,现有下列几种说法:
①用物质A表示的反应的平均速率为0.3 mol·L-1·s-1 ;
②用物质B表示的反应的平均速率为0.6 mol·L-1·s-1;
③2s时物质A的转化率为30% ;
④2s时物质B的浓度为1.4mol·L-1。
其中正确的是( )
A. ①③ B. ①④ C. ②③ D. ③④
查看答案和解析>>
科目:高中化学 来源:河北省2016-2017学年高一下学期开学考试化学试卷 题型:选择题
下列实验的操作,通常情况下不能相互接触的是
A. 用胶头滴管向试管中滴加液体时,滴管尖端与试管内壁
B. 过滤操作中,玻璃棒与三层滤纸
C. 过滤操作中,漏斗下端管口与烧杯内壁
D. 分液操作中,分液漏斗下端管口与烧杯内壁
查看答案和解析>>
科目:高中化学 来源:河北省2016-2017学年高一下学期开学考试化学试卷 题型:选择题
下列各离子组在指定的溶液中一定能大量共存的是 ( )
①常温在C(H+)/C(OH-)= 10-10溶液中:K+、Na+、CH3COO-、SO42﹣
②常温pH=11的溶液中:CO32﹣、Na+、AlO2﹣、NO3﹣
③水电离出的H+浓度c(H+)=10﹣12mol•L?1的溶液中:Cl﹣、NO3﹣、Na+、S2O32﹣
④使甲基橙变红色的溶液中:Fe3+、NO3﹣、Na+、SO42﹣
A. ①②③ B. ①②④ C. ②③④ D. ①③④
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省广州市高一上学期期期末考试化学试卷(解析版) 题型:填空题
硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3 、FeCO3 、MgO、CaO等,生产工艺流程示意如下:

请回答下列问题:
(1)将菱锌矿研磨成粉的目的是:______________________________。
(2)漂白粉的有效成分是NaClO,请完成“氧化除铁”步骤中反应的离子方程式:_______________________
□Fe(OH)2+ □ClO- + □_____= □Fe(OH)3 + □ Cl-
(3)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,相对分子质量为89,化学式是____________(不用考虑化学式中各元素的排列顺序)。
(4)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为________________。
Mg(OH)2 | Zn(OH)2 | |
开始沉淀的pH | 10.4 | 6.4 |
沉淀完全的pH | 12.4 | 8.0 |
开始溶解的pH | — | 10.5 |
(5)假设各步转化均完全,分析图中数据可知:菱锌矿粉中ZnCO3的质量是_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com