
| A. | pH=1的溶液中:Mg2+,CO${\;}_{3}^{2-}$,SO${\;}_{4}^{2-}$,Na+ | |
| B. | c(Fe3+)=0.1mol•L-1的溶液中:K+,SO${\;}_{4}^{2-}$,OH- | |
| C. | 使石蕊试液变蓝色的溶液中:Mg2+,Cl-,K+ | |
| D. | 使酚酞变红的溶液中:Na+,Cl-,SO${\;}_{4}^{2-}$ |
分析 A.pH=1的溶液呈酸性,与氢离子反应的离子不能大量共存;
B.与Fe3+反应的离子不能大量共存;
C.使石蕊试液变蓝色的溶液呈碱性,与OH-反应的离子不能大量共存;
D.使酚酞变红的溶液呈碱性.
解答 解:A.pH=1的溶液呈酸性,酸性条件下,CO32-不能大量共存,故A错误;
B.OH-与Fe3+反应生成沉淀,不能大量共存,故B错误;
C.使石蕊试液变蓝色的溶液呈碱性,Mg2+与OH-反应生成沉淀而不能大量共存,故C错误;
D.使酚酞变红的溶液呈碱性,离子之间不发生任何反应,可大量共存,故D正确.
故选D.
点评 本题考查离子共存问题,为高频考点,和常见题型,侧重于元素化合物知识的综合理解和运用的考查,注意把握题给信息以及隐含条件,难度不大.


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,18g H20体积为22.4L | |
| B. | 2L 0.5mol/L CH3COOH溶液中含有的H+的数目为NA | |
| C. | 0.1mol锌与足量稀硫酸反应,转移的电子数为0.1NA | |
| D. | 常温常压下4.6g NO2与N2O4的混合气体,原子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| HA | H2B | H2C | H3D |
| 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 | 氯化钙 |
| 水中的溶解性 | 可溶于冷水易溶于热水 | 可溶 | 易溶 | 易溶 |
| 乙醇中的溶解性 | 微溶 | 微溶 | 可溶 | 可溶 |
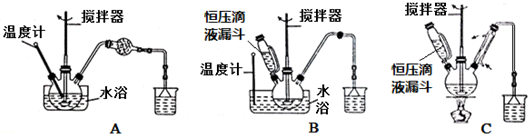
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com