
【题目】某学生用0.10 mol/L标准NaOH溶液滴定某浓度的盐酸。记录数据如下:
实验编号 | NaOH溶液的浓度(mol/L) | 消耗NaOH溶液的体积(mL) | 待测盐酸溶液的体积(mL) |
1 | 0.10 | 19.98 | 20.00 |
2 | 0.10 | 20.02 | 20.00 |
3 | 0.10 | 20.00 | 20.00 |
(1)滴定时可用的指示剂是__________________。
A.品红溶液 B.酚酞试液 C.石蕊试液
(2)排去碱式滴定管中气泡的方法应采用操作_________,然后轻轻挤压玻璃球使尖嘴部分充满碱液。

(3)滴定操作时,眼睛应注视____________________________________________。
(4)滴定达到终点的现象____________________________________________________。
(5)碱式滴定管尖嘴部分有气泡,滴定后消失,对测定结果的影响是_______(填“偏高”或“偏低”或“不影响”,下同);碱式滴定管滴定前仰视滴定后俯视,对测定结果的影响是_______;锥形瓶用水洗净后没用酸润洗,结果会________。
(6)根据上述数据,计算出该盐酸的浓度约为__________________(保留两位有效数字)。
【答案】B C 锥形瓶中溶液的颜色变化 滴入最后一滴NaOH溶液,溶液颜色由无色变为粉红色且半分钟内不褪色,说明到达终点 偏高 偏低 无影响 0.10 mol/L
【解析】
(1)强酸与强碱反应生成强酸强碱盐,溶液呈中性,可选择酚酞或甲基橙作指示剂;
(2)根据碱式滴定管中排气泡的方法;
(3)根据中和滴定中,眼睛应注视的是锥形瓶中溶液颜色变化,滴定终点判断;
(4)根据溶液颜色变化且半分钟内不变色,可说明达到滴定终点;
(5)根据滴定管尖嘴处有气泡,使得标准液的消耗体积变大;碱式滴定管滴定前仰视滴定后俯视,使得标准液的消耗体积变小;锥形瓶用水洗净后没用酸润洗,待测液的物质的量不变。
(6)先分析数据的有效性,求出消耗盐酸的平均体积,然后根据c(酸)=[c(碱)×V(碱)]/ V(酸)计算。
(1)NaOH溶液与盐酸反应生成强酸强碱盐,溶液呈中性,可选择酚酞或甲基橙作指示剂,故答案为:B;
(2)碱式滴定管中排气泡的方法是把滴定管的胶头部分稍微向上弯曲,再排气泡,故答案为:C;
(3)滴定时,眼睛要注视着锥形瓶内溶液颜色的变化,故答案为:锥形瓶内溶液颜色的变化;
(4)滴定达到终点的现象是当滴入最后一滴NaOH溶液,溶液由无色变为粉红色,且半分钟内不褪色,即为终点,故答案为:最后一滴NaOH溶液加入时,溶液颜色恰好由无色变为浅红色,且半分钟内不褪色;
(5)碱式滴定管尖嘴部分有气泡,滴定后消失,由于气泡的体积计入了标准液消耗的体积,使得标准液体积比实际体积增大,测定结果偏高;碱式滴定管滴定前仰视导致读数体积偏大,滴定后俯视导致读数体积偏小,使得标准液体积比实际体积减小,测定结果偏低;锥形瓶水洗后未干燥,待测液的物质的量不变,V(标)不变,对测定结果无影响;故答案为:偏高;偏低;无影响;
(6)三次数据均有效,平均消耗V(NaOH溶液)=(19.98+20.02+20.00)mL /3=20.00mL,所以c(酸)=[c(碱)×V(碱)]/V(酸)=(0.10mol/L×20.00mL)/20.00mL=0.10 mol/L,故答案为:0.10 mol/。


科目:高中化学 来源: 题型:
【题目】合理利用资源,加强环境保护,降低碳排放,实施低碳经济是今后经济生活主流。回答下列问题:
(1)下列措施不利于有效减少二氧化碳的是______(填字母)。
a.植树造林,保护森林,保护植被
b.加大对煤和石油的开采,并鼓励使用液化石油气
c.大力发展风能、水力、潮汐能发电和核电,大力推行太阳能的综合开发
d.推广使用节能灯和节能电器,使用空调时夏季温度不宜设置过低,冬天不宜过高
(2)科学家致力于二氧化碳的“组合转化”技术研究,如将CO2和H2以1∶4的物质的量之比混合通入反应器,在适当条件下反应可获得一种重要能源。请完成以下化学方程式:CO2+4H2![]() _____+2H2O。
_____+2H2O。
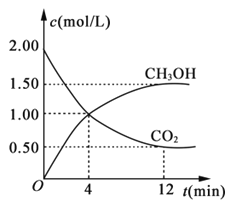
(3)用CO2合成燃料甲醇(CH3OH)是碳减排的新方向。现进行如下实验:某温度下在体积为1L的密闭容器中,充入2molCO2和6molH2,发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。现测得CO2和CH3OH(g)的浓度随时间变化如图所示。从反应开始到平衡,氢气的平均反应速率v(H2)=___。
CH3OH(g)+H2O(g)。现测得CO2和CH3OH(g)的浓度随时间变化如图所示。从反应开始到平衡,氢气的平均反应速率v(H2)=___。
(4)以KOH为电解质的甲醇燃料电池总反应为2CH3OH+3O2+4KOH=2K2CO3+6H2O。通入甲醇的电极为燃料电池的______(填“正”或“负”)极,正极反应式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙(CaO2)是一种白色、无毒、难溶于水的固体,加热至350 ℃左右开始分解放出氧气。过氧化钙能杀菌消毒,广泛用于果蔬保鲜、空气净化、污水处理等方面。其工业制备的主要流程如下:
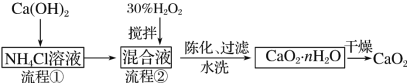
(1)搅拌的目的是______。流程②中没有采用加热措施的可能原因是______、______。流程②的化学反应方程式为________________。
(2)整个流程中,除水外还可以循环使用的物质是______。
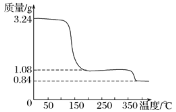
(3)取上述制得的CaO2·nH2O晶体进行热重分析,其热分解时晶体的质量随温度变化的曲线如右图。请通过计算给出过氧化钙晶体(CaO2·nH2O)的化学式(写出计算过程) __________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,质量相同的CO2、H2、O2、CH4、SO2五种气体,下列说法错误的是
A.所占的体积由大到小的顺序是:H2>CH4>O2>CO2>SO2
B.所含分子数由多到少的顺序是:H2>CH4>O2>CO2>SO2
C.所含的电子数由多到少的顺序是:SO2>CO2>O2>CH4>H2
D.密度由大到小的顺序是:SO2>CO2>O2>CH4>H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种短周期元素在周期表中的位置如图所示,其中R元素原子的最外层电子数和K层电子数之和等于其次外层电子数,下列判断正确的是
![]()
A. 简单离子的半径大小:Y>Z>R
B. Z的氢氧化物虽然溶解度很小,导电性很差,但它是强电解质
C. Y与X能形成熔点很高的晶体,它是由极性键组成的非极性分子
D. Y与M的最高价氧化物对应的水化物的导电性,Y的不一定比M的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无论以何种比例混合的10mL混和气,在50mL的氧气中燃烧生成CO2和液态的H2O,燃烧后所得气体的体积为35mL,则该混合物可能为
A. C3H6 C4H6 B. C2H6 C3H6
C. C2H4 C3H8 D. C2H2 C2H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有0.2mol某有机物和0.5mol氧气在一密闭容器中燃烧得产物为CO2、CO、H2O(气)。产物依次通过浓硫酸时,浓硫酸的质量增加了 10.8g;再通过灼热的氧化铜时,氧化铜的质量减轻了 3.2g;又通过碱石灰时,碱石灰的质量增加了17.6g。该有机物的化学式是( )
A. C2H4 B. C2H6O2 C. C2H6O D. C3H6O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】严重雾霾天气的产生与汽车排放的NO2(N2O4)、CO、NO等气体有关。回答下列问题:
(1)用活性炭对尾气进行处理,发生如下反应:
反应a:C(s)+NO2(g)![]() 1/2N2(g)+CO2(g) ΔH=-32.1kJ·mol1
1/2N2(g)+CO2(g) ΔH=-32.1kJ·mol1
反应b:2C(s)+N2O4(g)![]() N2(g)+2CO2(g) ΔH=-28.2kJ·mol1
N2(g)+2CO2(g) ΔH=-28.2kJ·mol1
则NO2生成N2O4的热化学方程式为____。
(2)用活性炭处理尾气时还可发生反应:C(s)+2NO(g)![]() N2(g)+CO2(g) ΔH=-34.0 kJ·mol1,借助传感器在T1℃测得不同时间点上NO和N2的浓度如下:
N2(g)+CO2(g) ΔH=-34.0 kJ·mol1,借助传感器在T1℃测得不同时间点上NO和N2的浓度如下:
时间/min 浓度/mol·L1 物质 | 0 | 5 | 10 | 15 | 20 | 25 |
NO | 1.20 | 0.74 | 0.56 | 0.56 | 0.63 | 0.63 |
N2 | 0 | 0.23 | 0.32 | 0.32 | 0.36 | 0.36 /td> |
①15 min后,只改变某一条件,反应重新达到平衡;根据上表数据判断改变的条件可能是___(填字母)。
a.适当缩小容器的体积 b.加入适量的活性炭
c.通入适量的NO d.适当升高温度
②0~10 min内,CO2的平均反应速率v(CO2)=___。
(3)用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在密闭容器中加入足量的C和一定量的N2O4气体,维持温度T2℃,在不同压强下发生(1)中反应b,经过相同时间N2O4的转化率随压强变化如图所示:
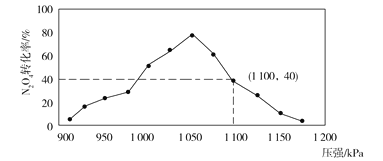
在1.1×106 Pa时该反应的化学平衡常数Kp=___(结果保留两位有效数字。已知:气体分压(p分)=气体总压(p总)×体积分数)。
(4)用I2O5吸收汽车尾气中的CO,发生I2O5(s)+5CO(g)![]() 5CO2(g)+I2(g) ΔH=Q,在容积为1 L的密闭容器中充入5 mol CO和足量的I2O5模拟该反应。
5CO2(g)+I2(g) ΔH=Q,在容积为1 L的密闭容器中充入5 mol CO和足量的I2O5模拟该反应。
①测得CO的平衡转化率随温度变化的关系如图,下列说法正确的是____(填字母)。
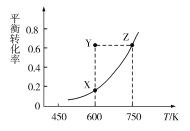
A.Q<0
B.从X点到Y点可通过通入CO实现
C.从Y点到Z点可通过增大压强实现
D.600 K时,Y点CO的v正<v逆
②已知Y点的坐标为(600K,0.6),在此条件下I2(g)的体积分数为___。(精确到0.1%)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学原理在防止金属腐蚀、能量转换等方面应用广泛。
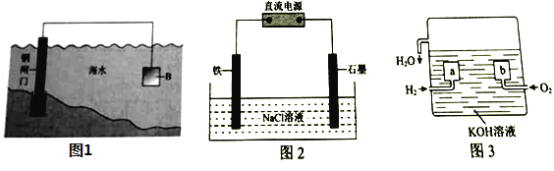
(1)①钢铁在海水中容易发生电化学腐蚀,负极反应式是____________。
②图1中,为减缓钢闸门的腐蚀,材料![]() 可以选择____________(填“
可以选择____________(填“![]() ”或“
”或“![]() ”)。
”)。
(2)图2为钢铁防护模拟实验装置,则铁做_________极,检测钢铁保护效果的方法是:取少量铁电极附近的溶液于试管中,___________,则说明保护效果好。
(3)氢氧燃料电池是一种新型的化学电源,其构造如图3所示:![]() 为多孔石墨电极,通入的气体由孔隙中逸出,并在电极表面放电。
为多孔石墨电极,通入的气体由孔隙中逸出,并在电极表面放电。
①![]() 的电极反应式是__________________;
的电极反应式是__________________;
②若电池共产生![]() 水,则电路中通过了___________
水,则电路中通过了___________![]() 的电子。
的电子。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com