
| 元素 | Al | B | Be | C | Cl | F | Li | Mg | N | Na | O | P | S | Si |
| 电负性 | 1.5 | 2. | 1.5 | 2.5 | 2.8 | 4. | 1.0 | 1.2 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.7 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解

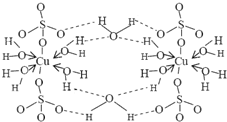


查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:022
|
元素 |
Al |
B |
Be |
C |
Cl |
F |
Li |
|
电负性 |
1.61 |
2.04 |
1.57 |
2.55 |
3.16 |
3.98 |
0.98 |
|
元 素 |
Mg |
N |
Na |
O |
P |
S |
Si |
|
电负性 |
1.31 |
3.04 |
0.93 |
3.44 |
2.19 |
2.58 |
1.90 |
试结合元素周期律知识完成下列问题:
(1)根据上表给出的数据,可推知元素的电负性的变化规律是:_______________________________________________________________________________。
(2)预测Br与Ⅰ元素电负性的大小关系________________,电负性最小的元素在周期表中的位置是:___________________________________(放射性元素除外)。
(3)习惯上把SrI2作为离子化合物,把BaS作为共价化合物。(电负性Sr=0.95;I=2.66;Ba=0.89;S=2.58)我们把两成键原子的电负性差值用DX表示,请找出用DX来判断离子键或共价键的数值范围:即当DX________时一般为离子键,当DX________时一般为共价键。试判断AlBr3中化学键的类型是________。
查看答案和解析>>
科目:高中化学 来源: 题型:022
已知元素的电负性和原子半径等内容一样,也是元素的一种基本性质,下面给出14种元素的电负性:
|
元素 |
Al |
B |
Be |
C |
Cl |
F |
Li |
|
电负性 |
1.61 |
2.04 |
1.57 |
2.55 |
3.16 |
3.98 |
0.98 |
|
元 素 |
Mg |
N |
Na |
O |
P |
S |
Si |
|
电负性 |
1.31 |
3.04 |
0.93 |
3.44 |
2.19 |
2.58 |
1.90 |
试结合元素周期律知识完成下列问题:
(1)根据上表给出的数据,可推知元素的电负性的变化规律是:_______________________________________________________________________________。
(2)预测Br与Ⅰ元素电负性的大小关系________________,电负性最小的元素在周期表中的位置是:___________________________________(放射性元素除外)。
(3)习惯上把SrI2作为离子化合物,把BaS作为共价化合物。(电负性Sr=0.95;I=2.66;Ba=0.89;S=2.58)我们把两成键原子的电负性差值用DX表示,请找出用DX来判断离子键或共价键的数值范围:即当DX________时一般为离子键,当DX________时一般为共价键。试判断AlBr3中化学键的类型是________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年陕西省高三上学期第三次教学质量检测理综化学试卷(解析版) 题型:填空题
第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物。(1)下列叙述正确的是 。(填字母)
A.CH2O与水分子间能形成氢键 B.CH2O和CO2分子中的中心原子均采用sp2杂化
C.C6H6分子中含有6个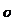 键和1个大
键和1个大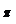 键,C6H6是非极性分子
键,C6H6是非极性分子
D.CO2晶体的熔点、沸点都比二氧化硅晶体的低
(2)Mn和Fe的部分电离能数据如下表:
|
元 素 |
Mn |
Fe |
|
|
电离能 /kJ·mol-1 |
I1 |
717 |
759 |
|
I2 |
1509 |
1561 |
|
|
I3 |
3248 |
2957 |
Mn元素价电子排布式为 ,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,其原因是 。
(3)根据元素原子的外围电子排布的特征,可将元素周期表分成五个区域,其中Ti属于 区。
(4)Ti的一种氧化物X,其晶胞结构如图所示,则X的化学式为 。已知晶胞边长为bcm,阿伏伽德罗常数为NA该氧化物的密度为__________________g/cm-3

(5)电镀厂排放的废水中常含有剧毒的CN-离子,可在X的催化下,先用NaClO将CN-氧化成CNO-,再在酸性条件下CNO-继续被NaClO氧化成N2和CO2。
①H、C、N、O四种元素的电负性由小到大的顺序为 。
②与CNO-互为等电子体微粒的化学式为 (写出一种即可)。
③氰酸(HOCN)是一种链状分子,它与异氰酸(HNCO)互为同分异构体,其分子内各原子最外层均已达到稳定结构,试写出氰酸的结构式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知元素的电负性与元素的化合价一样,也是元素的一种基本性质。下面给出14种元素的电负性。
| 元 素 | Al | B | Be | C | Cl | F | Li | Mg | N | Na | O | P | S | Si |
| 电负 性 | 1.5 | 2. | 1.5 | 2.5 | 2.8 | 4. | 1.0 | 1.2 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.7 |
根据以上的数据,可推知元素的电负性具有的变化规律是: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com