
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:013
A.此化合物含铝和碳共0.7mol,其中有10.8g铝和0.3mol碳
B.此化合物中铝和碳的物质的量之比为4∶3
C.此化合物中铝和碳的质量比为4∶3
D.此化合物0.1mol,化学式为Al4C3
查看答案和解析>>
科目:高中化学 来源: 题型:013
某化合物只含铝元素和碳元素。已知此化合物14.4g中含有0.4mol铝,由此可知下列说法中错误的是( )
A.此化合物含铝和碳共0.7mol,其中有10.8g铝和0.3mol碳
B.此化合物中铝和碳的物质的量之比为4∶3
C.此化合物中铝和碳的质量比为4∶3
D.此化合物0.1mol,化学式为Al4C3
查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东省惠州市高三第三次调研考试理综化学试卷(解析版) 题型:填空题
某氧化铁样品中含有少量的FeSO4杂质。某同学要测定其中铁元素的质量分数,他设计了如下方案进行测定,操作流程为:
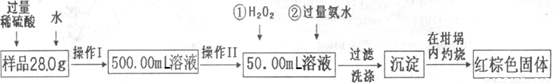
请根据流程回答:
(1)操作I中配制溶液时,所用到的玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管以外,还必须有 (填仪器名称)。
(2)操作II中必须用到的仪器是 。
A.50mL量筒 B.100mL量筒
C.50mL酸式滴定管 D.50mL碱式滴定管
(3)反应①中,加入足量H2O2溶液反应的离子方程式 。
(4)检验沉淀中SO42-是否冼涤干净的操作
。
(5)将沉淀物加热,冷却至室温,用天平称量坩埚与加热后固体的总质量为blg,再次加热并冷却至室温称量其质量为b2g,若b1—b2=0.3,还应进行的操作是
。
(6)若坩埚的质量为42.6g,最终坩埚与加热后同体的总质量为44.8g,则样品中铁元素的质量分数= (保留一位小数)。
(7)另一同学认为上述方案的实验步骤太繁琐,他认为,只要将样品溶于水后充分搅拌,加热蒸干灼烧称量即可,请你评价他的这个方案是否可行? 。(填“可行”或“不可行”)
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com