
����Ŀ��Na2O2����ѧ��ѧ���õ�ǿ����������������CO2��H2O��Ӧ�⣬������������ԭ����H2��C������Ӧ��ij��ѧ������ȤС��Ϊ̽��Na2O2��H2�ķ�Ӧ��������������ͼ��ʾװ�ý����й�ʵ�顣
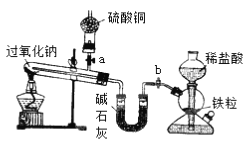
��1����װ���У������������շ�����֮���װ�õ������ԣ�_________________________________��
��2������ɸ�ʵ����йز������衣
�ټ��װ�������ԣ�
�ڴ�a��b�����������۲��Թ������ʵ���ɫ�仯��
��____________________________________________________��
�ܼ��ȹ������ƣ��۲��Թ������ʵ���ɫ�仯��
�ݷ�Ӧ��ȫ��__________________________________________��
��жװ�á�
��3����װ���У���ʯ�ҵ�������_________________________ ��
��4��ʵ������й۲쵽(2)�в���������Ա仯�������Na2O2�ۻ���ɫ��ĩ������ɰ�ɫ�������������ͭδ�����ɫ����Na2O2��H2��Ӧ�Ļ�ѧ����ʽΪ_________��
���𰸡� �ر�a����b������һ���ܲ�����ˮ���У����������Թ�(�����Լ����Թ�)�����۲쵽���ܿ�������ð������ȴ�Թܺ������γ�һ���ȶ���ˮ������˵��װ������������ �ڸ�����ϵ���һ֧С�Թ��ռ�H2������H2�Ĵ��� �ȳ���ƾ��ƣ����Թ���ȴ��ر�b ��ȥH2�е�HCl��ˮ���� Na2O2��H2![]() 2NaOH
2NaOH
���������������������ͨ��̽��Na2O2��H2�ķ�Ӧ������װ�������Եļ�飬����ʵ�鲽�裬ʵ������ķ�������ѧ����ʽ����д��
��1���������շ�����֮���װ�õ������Կ����ȷ����������Ϊ���ر�a����b������һ���ܲ�����ˮ���У����������Թ��������Լ����Թ��������۲쵽���ܿ�������ð������ȴ�Թܺ������γ�һ���ȶ���ˮ������˵��װ��������������
��2������������̽��H2��Na2O2�������ܷ�Ӧ��ͬʱ�ɽ�װ���п����ų������������ȹ������ƣ�����̽��H2��Na2O2����ʱ�ķ�Ӧ������Ҫ���ȣ���H2����ʱ�ᷢ����ը�����Լ��ȹ�������֮ǰҪ����H2�Ĵ��ȣ�������Ϊ�ڸ�����ϵ���һ֧С�Թ��ռ�H2������H2�Ĵ��ȡ�ʵ�����ʱ��Ϊ�˷�ֹ�������Ӹ���ܽ����Թ���ʹH2����������ը��������Ӧ�ȳ���ƾ��ƣ����Թ���ȴ��ر�b�������Թ���ȴ��ֹͣͨ��H2����
��3����������ϡ���ᷴӦ�Ƶõ�H2�л���HCl��H2O��g����HCl��H2O��g��������Na2O2��Ӧ������̽��Na2O2��H2�ķ�Ӧ����ʯ�ҵ������dz�ȥH2�е�HCl��H2O��g����
��4���������������Ա仯��Na2O2��H2�����²���Ӧ��������Na2O2�ۻ�����ɫ��ĩ��ɰ�ɫ�������������ͭδ�����ɫ��˵����Ӧû������H2O��˵��Na2O2��H2����ʱ��Ӧ����NaOH����Ӧ�Ļ�ѧ����ʽΪNa2O2+H2![]() 2NaOH��
2NaOH��


 ��������ϵ�д�
��������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CO2��H2�Ļ������5g����150��ʱ������������������õ�����ȼ������ͬ״�����ٽ���Ӧ�����û������ͨ�뵽������Na2O2�������Na2O2�������ص�����Ϊ3.4g����ԭ���������CO2�����ʵ�������Ϊ�� ��
A. 25% B. 75% C. 88% D. 32%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CO2�Ļ������öԼ������������ŷš������������滷��������Ҫ���壮����CO2��CH4�������ƺϳ�������Ҫ�ɷ�CO��H2�������������в��ַ�Ӧ���Ȼ�ѧ����ʽΪ�� ��CH4��g���TC��s��+2H2��g����H=75.0kJmol��1
��CO2��g��+H2��g���TCO��g��+H2O��g����H=41.0kJmol��1
��CO��g��+H2��g���TC��s��+H2O��g����H=��131.0kJmol��1
��1����ӦCO2��g��+CH4��g���T2CO��g��+2H2��g���ġ�H= ��
��2���̶�n��CO2��=n��CH4�����ı䷴Ӧ�¶ȣ�CO2��CH4��ƽ��ת���ʼ�ͼ1�� 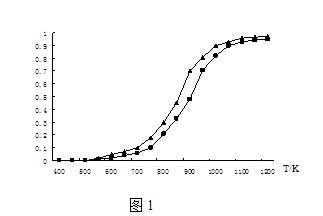
��ͬ�¶���CO2��ƽ��ת����������ڡ���С�ڡ�����CH4��ƽ��ת���ʣ���ԭ���� ��
�ڸ����½��и÷�Ӧʱ������Ӧ�����ɡ���̼����̼���ʣ�����ɴ����ж��������·�Ӧ�����Է����е�ԭ���� ��
��3��һ��������Pd��Mg/SiO2������ʹCO2�����黯���Ӷ����Ϊ�����䷴Ӧ������ͼ2��ʾ���÷�Ӧ�Ļ�ѧ����ʽΪ �� ��Ӧ������̼Ԫ�صĻ��ϼ�Ϊ��2�۵��м����� �� 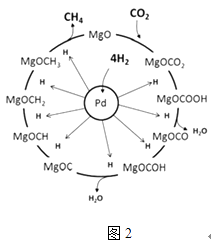
��4��±ˮ���������̵�����CO2��ͬʱ��������ʵ���Է��ηϣ������漰��һ����Ӧ��CaSO4+Na2CO3�TCaCO3+Na2SO4 �� ��ﵽƽ�����Һ�� ![]() = �� [��Ksp��CaSO4����Ksp��CaCO3����ʾ]��
= �� [��Ksp��CaSO4����Ksp��CaCO3����ʾ]��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��Ӧ�Ǿɼ����Ѻ��¼��γɵĹ��̡����ۼ��ļ���������ԭ�Ӽ��γ�1 mol���ۼ�(���������)ʱ�ͷ�(������)����������֪���滯ѧ���ļ��ܣ� H��H Br��Br H��Br ����(kJ��mol��1) 436 193 366����Br2(g)��H2(g)��2HBr(g)�ķ�Ӧ����H����( )
A. -183 kJ��mol��1B. 183 kJ��mol��1C. -103 kJ��mol��1D. 103 kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������pH=5��CH3COOH��Һ��ˮϡ��1000����ϡ�ͺ���Һ�еģ� ��
A.pH=8
B.pH=7
C.pH=6
D.pH���ӽ�7
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ɫ��Һ��������������H2�����ڸ���Һ��һ���ܴ������ڵ���������(����)
A. K����Cu2����NO![]() ��Cl�� B. K����Na����Br����Cl��
��Cl�� B. K����Na����Br����Cl��
C. K����Ca2����HCO![]() ��Cl�� D. Na����Mg2����Br����SO
��Cl�� D. Na����Mg2����Br����SO![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£����ܱ������н���SO2�Ĵ�������Ӧ������ʼʱc��SO2��=c��O2��=6mol/L��ƽ��ʱ���c��O2��=4.5mol/L����������������ȷ���ǣ� ��
A.SO2��ת����Ϊ60%
B.SO3�IJ���Ϊ60%
C.ƽ��ʱ��ѹǿ����ʼѹǿ֮��Ϊ7��8
D.ƽ��ʱV��SO2����V��O2����V��SO3��=3��3��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ҫ����ɫ����֮һ����������һ�㺬��Fe��Cu�������ᡢ����Һ��Ӧ�IJ��������ʶ�Ӱ��ʹ�ã��ֶԴ��������ᴿ������ķ�Ӧ�������£�
��֪��
��2Ni2O3����ɫ�� ![]() 4NiO����ɫ��+O2��
4NiO����ɫ��+O2��
��
���� | CuS | Cu��OH��2 | Ni��OH��2 | NiS |
Ksp | 8.8��10��38 | 2.2��10��20 | 5.48��10��18 | 3.2��1018 |
������Ϣ�ش�
��1��28Ni�����ڱ��еĵ����ڣ�����ϡ���ᷴӦ�����ӷ���ʽΪ �� ʵ��������Ľ��������¶��йأ������¶��������Ľ������������¶ȸ���70��ʱ�����Ľ������ֽ��ͣ���������Ni��OH��2����������ԭ��Ϊ��
��2������ҺA�ľ��������У��ȵ���PH=5.5���������5min������һ��ʱ����˳�Fe��OH��3 �� Ϊ�˵õ���������ҺB����Ҫ���������������г��ӣ�����ȷ�𰸱�ţ���
A.NaOH
B.Na2S
C.H2S
D.NH3�qH2O
��3����֪�����������ʵ��ܽ�ȹ�ϵ��NiC2O4��NiC2O4H2O��NiC2O42H2O������ҺC�õ�����D�IJ����������ˡ�������������ƣ��� D����E�Ļ�ѧ����ʽΪ
��4��1molE���������̵õ������������ϲμӷ�Ӧ������Ϊ mol��
��5���ⶨ��Ʒ�е��������Ļ���˼·�ǽ�Ni2+ת��Ϊ������ͨ������������������һ������Ni��������֪Ni2+����CO32�� �� C2O42����S2���������γɳ��������ⶨʱ��ѡ�ö���ͪ뿣�C4H8N2O2���������������ɷ���ʽΪC8H14N4O4Ni���ʺ�ɫ��������ʵ�����Ƕȷ�����Ҫԭ��Ϊ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ˮ��״̬��������Һ��̬�⣬���в���̬��������Һ̬ˮ������ȴ��165K������108����ʱ�γɵģ�����̬��ˮ�̶���״�������ھ���ṹ�����ܶ�����ͨҺ̬ˮ���ܶ���ͬ���йز���̬ˮ��������ȷ���ǣ� ��
A.ˮ��Һ̬��Ϊ����̬�������СB.ˮ��Һ̬��Ϊ����̬���������
C.����̬��ˮ��һ������״̬D.����̬ˮ�Ƿ��Ӿ���
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com