
将2.56gCu和一定量的浓HNO3反应,随着Cu的不断减少,反应生成气体的颜色逐渐变浅, 当Cu反应完毕时,共收集到气体1.12L(标准状况),则反应中消耗HNO3的物质的量为
A. 0.05 mol B. 1 mol C. 1.05 mol D. 0.13 mol
 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:高中化学 来源:2016-2017学年辽宁省六校协作体高一下学期期初化学试卷(解析版) 题型:选择题
下列实验用来证明SO2的存在,其中正确的是
A. 能使品红褪色
B. 能使湿润的蓝色石蕊试纸变红
C. 通入足量的NaOH溶液中,再滴入BaCl2溶液有白色沉淀生成,该沉淀溶于
稀盐酸
D. 通入新制氯水中能使新制氯水褪色,得澄清溶液,再滴加Ba(NO3)2溶液有
查看答案和解析>>
科目:高中化学 来源:河北省2016-2017学年高一下学期开学考试化学试卷 题型:选择题
下列说法正确的是
A. 氧化剂在反应中失去电子,还原剂在反应中得到电子
B. 金属在反应中只能作还原剂,非金属在反应中只能作氧化剂
C. 阳离子只有氧化性,阴离子只有还原性
D. 氧化剂具有氧化性,还原剂具有还原性
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省高一下学期开学考试化学试卷(解析版) 题型:实验题
在半导体工业中,有一道工序叫烧氢。烧氢的工艺流程如图所示。

工作时,是将石英管D出口处氢气点燃。半导体硅片、焊片和金属零件从石英管口送入加热区,在氢气还原气氛中加热使焊片熔化,将单晶硅与金属零件焊接在一起。焊接后再将零件拉至冷却区,冷却后取出。烧氢工艺中的氢气纯度要求极高,工业氢气虽含氢量达99.9%,但仍含有极微量的水蒸气和氧气,所以点燃氢气前应检验氢气的纯度。试回答下列问题:
(1)装置B的作用是________;B中发生反应的化学方程式是________。
(2)装置C中的物质是________;C的作用是________。
(3)点燃氢气前将E(带导管胶塞)接在D出口处,目的是________。
(4)装置A是安全瓶,可以防止氢气燃烧回火,引起爆炸,其中填充大量纯铜屑的作用是________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省高一下学期开学考试化学试卷(解析版) 题型:选择题
将0.4g NaOH和1.06g Na2CO3合并配成溶液,向溶液中滴加0.lmol·L—l的盐酸。下图象能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是

A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省高一下学期开学考试化学试卷(解析版) 题型:选择题
有BaCl2和NaCl混合溶液aL,将它均分成两份。一份滴加硫酸,使Ba2+完全沉淀;另一份滴加AgNO3溶液,使Cl-完全沉淀.反应中消耗 x mol H2SO4、y mol AgNO3.据此得知原混合溶液中的c(Na+)为
A. (2y-4x) /a mol·L-1 B. (y-2x) /a mol·L-1
C. (2y-2x) /a mol·L-1 D. (y-x) /a mol·L-1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年新疆兵团农二师华山中学高一下学期学前考试化学试卷(解析版) 题型:简答题
某无色透明溶液中可能存在大量Ag+、Mg2+、Fe3+、Cu2+中的一种或几种,请填写下列空白。
(1)不用做任何实验就可以肯定溶液中不存在的离子是________________。
(2)取少量原溶液,加入过量稀盐酸,有白色沉淀生成,再加入过量稀硝酸,沉淀不消失,说明原溶液中肯定存在的离子是________,有关反应的离子方程式为________________。
(3)取 (2)的滤液加过量的NaOH溶液,出现白色沉淀,说明原溶液中肯定有________,有关反应的离子方程式为________________。
(4)原溶液中可能大量存在的阴离子是________(填序号)。
A.Cl- B.NO C. CO
C. CO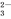 D.OH-
D.OH-
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省广州市高一上学期期期末考试化学试卷(解析版) 题型:实验题
Ⅰ、Na2O2与SO3(g)的反应类似于Na2O2与CO2(g)的反应,请写出Na2O2与SO3反应的化学方程式:_____________________。
Ⅱ、某学生课外活动小组模拟呼吸面具中的反应原理,设计用下图所示的仪器来制取氧气并测量氧气的体积。图中量气装置E由甲乙两根玻璃管组成,它们由橡皮管连通,并装入适量水。甲管有刻度(0~50mL)供量气用,乙管可上下移动调节液面高低。实验可供选用的药品还有:稀硫酸、盐酸、过氧化钠、碳酸钠、大理石、水。

请回答下列问题:
(1)图中各装置接口连接顺序是_____________________(填各接口的编号,其中连接胶管及夹持装置均省略,):
→ → → ⑥ → ⑦ → → →
(2)装置D中发生反应的化学方程式为:_______________。
(3)装置B的作用是(用离子方程式表示):_______________。
(4)为了较准确测量氧气的体积,除了必须检查整个装置的气密性之外,在读反应前后甲管中液面的读数求其差值的过程中,还应注意_______(填字母编号)。
a.视线与液体凹液面最低处相平才读数
b.等待气体恢复常温才读数
c.上下移动乙管,使甲乙两管液面相平才读数
(5)实验测得收集的氧气在标准状况下体积为V L,则参与反应的Na2O2 的物质的量为________mol。
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三下学期期初考试化学试卷(解析版) 题型:推断题
我国从国外进口某原料经测定主要含有A、B、C、D、E五种前四周期元素,且原子序数依次增大。元素A、B、C、D、E的原子结构等信息如下:
元素 | 元素性质或原子结构 |
A | 周期表中原子半径最小的元素 |
B | 原子核外有三种不同的能级且各个能级所填充的电子数相同 |
C | 最外层p轨道半充满 |
D | 位于短周期,其原子的核外成对电子数是未成对电子数的3倍 |
E | 位于第四周期,内层电子全充满,且原子的最外层电子数与A的相同 |
请回答下列问题(用A、B、C、D、E所对应的元素符号作答):
(1)B、C、D第一电离能由小到大为_________________。
(2)E的基态原子的核外电子排布式为____________。
(3)A2B2D4常用作除锈剂,该分子中B的杂化方式为______________;1 mol A2B2D4分子中含有σ键数目为_____________。
(4)与化合物BD互为等电子体的阴离子化学式为_____________(任写一种)。
(5)B2A6、C2A4分子中均含有18个电子,它们的沸点相差较大,主要原因是____________。
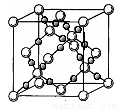
(6)BD2在高温高压下所形成晶体的晶胞如图所示。一个该晶胞中含___________个D原子。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com