
氧化还原滴定实验同中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之).现有0.001mol/L酸性KMnO4和未知浓度的无色NaHSO3溶液,反应离子方程式是2MnO4- + 5HSO3- + H+ ===2Mn2+ + 5SO42- + 3H2O 填空回答问题:
(1)该滴定实验所需仪器有下列中的______________________________(填序号)
A.酸式滴定管 B.碱式滴定管 C.量筒 D.锥形瓶 E.铁架台 F.滴定管夹 G.烧杯 H.白纸 I.胶头滴管 J.漏斗
(2)滴定前平视KMnO4溶液,刻度为a mL,若滴定后(终点)俯视液面刻度为b mL,则(b-a)mL比实际消耗KMnO4溶液体积_________( 多、少)。根据(b-a)mL计算得到的待测液浓度比实际的浓度_________(大、小)。
科目:高中化学 来源: 题型:
I.有关中和滴定的操作有: ①用标准溶液润洗滴定管 ②往滴定管内注入标准溶液 ③检查滴定管是否漏水 ④滴定 ⑤洗涤
正确的操作顺序是 (填字母)
A. ⑤①②③④ B. ③⑤①②④ C. ⑤②③①④ D. ②①③⑤④
Ⅱ.氧化还原滴定实验同中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。现有0.001mol·L-1KMnO4酸性溶液和未知浓度的无色NaHSO3溶液。反应的离子方程式是:2MnO4-+5HSO3-+H+ = 2Mn2++5SO42-+3H2O
填空回答下列问题:
(1)不用 (填“酸式”或“碱式”)滴定管盛放高锰酸钾溶液。
(2)选何种指示剂 。(填序号)
①甲基橙 ②酚酞 ③ 石蕊 ④不用指示剂
(3)滴定前平视KMnO4液面,刻度为a mL,滴定后俯视液面刻度为b mL,则
(b-a)mL比实际消耗KMnO4溶液体积 (填“多”或“少”)。根据(b-a)mL计算得到的待测液浓度,比实际浓度 (填“大”或“小”)。
(4)无论是KMnO4溶液往NaHSO3溶液中滴,还是NaHSO3溶液往KMnO4溶液中滴,在其他操作正确规范的前提下,下列操作一定会使测定结果偏高的是 。(填序号)
①取用NaHSO3溶液的滴定管未用待测NaHSO3溶液润洗
②取用KMnO4酸性溶液的滴定管未用标准KMnO4酸性溶液润洗
③滴定过程中不慎有液体溅出
④滴定前仰视读数,滴定后平视读数
查看答案和解析>>
科目:高中化学 来源:2015届福建省福州市八县高二上学期期末考试化学试卷(解析版) 题型:实验题
实验题
(1)烧碱在保存过程会部分变质(杂质主要为Na2CO3)。
准确称取5.0g样品配制成250mL溶液,各取配制好的烧碱溶液10.00mL于锥形瓶中,分别向锥形瓶中各加入1~2滴酚酞指示剂,(已知:酚酞变色时,此时只有NaOH与HCl反应,Na2CO3还没有与HCl反应)用浓度为0.20mol·L-1的盐酸标准液进行滴定。相关数据记录如下:
|
实验编号 |
V(烧碱溶液)/mL |
V(盐酸)/mL |
|
|
初始读数 |
末尾读数 |
||
|
1 |
10.00 |
0.50 |
21.52 |
|
2 |
10.00 |
1.00 |
21.98 |
|
3 |
10.00 |
0.20 |
24.80 |
试回答:
①滴定时右手的正确操作是______________________________________。
②判断到达滴定终点的实验现象是__________________________________________,依据表中数据,计算出烧碱样品中含NaOH的质量分数为______ _%。
③下列操作会导致烧碱样品中NaOH含量测定值偏高的是__________。
A.锥形瓶用蒸馏水洗后未用待测液润洗
B.酸式滴定管用蒸馏水洗后未用标准液润洗
C.滴定过程中振荡锥形瓶时,有少量待测溶液溅出
D.滴定前平视读数,滴定结束仰视读数
(2)氧化还原滴定实验同中和滴定类似。过氧化氢是重要的氧化剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的浓度。已知:2KMnO4+5H2O2+6H2SO4===2MnSO4+8H2O+5O2↑,请填写下列空白:
①用 (填“酸式”或“碱式”)滴定管移取过氧化氢溶液25.00 mL至锥形瓶中,作被测试样。
②滴定时,将高锰酸钾标准溶液注入酸式滴定管中,高锰酸钾标准溶液用酸式滴定管原因为 。③重复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的物质的量浓度为 。
查看答案和解析>>
科目:高中化学 来源:2012年鲁科版高中化学选修6 3.2 物质中某组分含量的测定练习卷(解析版) 题型:填空题
氧化还原滴定实验同中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。现有0.001 mol·L-1酸性KMnO4溶液和未知浓度的无色NaHSO3溶液,反应离子方程式是2MnO4-+5HSO3-+H+===2Mn2++5SO42-+3H2O。填空回答问题:
(1)该滴定实验所需仪器有下列中的________。
A.酸式滴定管(50 mL) B.碱式滴定管(50 mL)
C.量筒(10 mL) D.锥形瓶
E.铁架台 F.滴定管夹
G.烧杯 H.白纸
I.胶头滴管 J.漏斗
(2)不能用________(填“酸”或“碱”)式滴定管盛放高锰酸钾溶液。试分析原因:________________________________________________________________________
__________________________。
(3)选何种指示剂,说明理由
________________________________________________________________________
__________________________。
(4)滴定前平视KMnO4液面,刻度为a mL,滴定后俯视液面刻度为b mL,则(b-a) mL比实际消耗KMnO4溶液体积________(填“多”或“少”)。根据(b-a) mL计算得到的待测浓度,比实际浓度________(填“大”或“小”)。
查看答案和解析>>
科目:高中化学 来源:2012年人教版高中化学选修6 3.2 物质含量的测定练习卷(解析版) 题型:填空题
氧化还原滴定实验同中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。现有0.001 mol·L-1KMnO4酸性溶液和未知浓度的无色NaHSO3溶液。反应离子方程式是2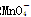 +
+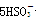 +H+===2Mn2++5
+H+===2Mn2++5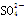 +3H2O,填空回答问题:
+3H2O,填空回答问题:
(1)该滴定实验所需仪器有下列中的________(填序号)。
A.酸式滴定管(50 mL) B.碱式滴定管(50 mL)
C.量筒(10 mL) D.锥形瓶
E.铁架台 F.滴定管夹
G.烧杯 H.白纸
I.胶头滴管 J.漏斗
(2)不用________(填“酸”或“碱”)式滴定管盛放高锰酸钾溶液。试分析原因:
________________________________________________________________________。
(3)选何种指示剂,说明理由
________________________________________________________________________。
(4)滴定前平视KMnO4液面,刻度为a mL,滴定后俯视液面刻度为b mL,则(b-a)mL比实际消耗KMnO4溶液体积偏________(填“多”或“少”)。根据(b-a) mL计算得到的待测浓度,比实际浓度偏________(填“大”或“小”)。
查看答案和解析>>
科目:高中化学 来源:2012届重庆市高二下学期第一次月考化学试卷 题型:实验题
(8分)氧化还原滴定实验同中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之).现有0.001mol/L酸性KMnO4和未知浓度的无色NaHSO3溶液,反应离子方程式是2MnO4- + 5HSO3- + H+ ==2Mn2+ + 5SO42- + 3H2O 填空回答问题:
(1)该滴定实验所需仪器有下列中的______________________________(填序号)
A.酸式滴定管 B.碱式滴定管 C.量筒 D.锥形瓶 E.铁架台 F.滴定管夹 G.烧杯 H.白纸 I.胶头滴管 J.漏斗
(2)滴定前平视KMnO4溶液,刻度为a mL,若滴定后(终点)俯视液面刻度为b mL,则(b-a)mL比实际消耗KMnO4溶液体积_________( 多、少)。根据(b-a)mL计算得到的待测液浓度比实际的浓度_________(大、小)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com