

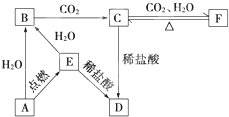
| A. | 图1中,铁钉易生锈 | |
| B. | 图2中,滴加少量K3[Fe(CN)6]溶液,没有蓝色沉淀出现 | |
| C. | 图3中,燃气灶的中心部位容易生锈,主要是由于高温下铁发生化学腐蚀 | |
| D. | 图4中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的正极 |
分析 A.浓硫酸具有吸水性,干燥条件下,铁钉不易被腐蚀;
B.Fe失电子生成亚铁离子;
C.高温下,Fe与氧气反应;
D.Fe、Mg构成原电池时,Mg的活泼性比Fe强,作负极.
解答 解:A.浓硫酸具有吸水性,能够干燥空气,干燥条件下,铁钉不易被腐蚀,故A错误;
B.Fe失电子生成亚铁离子,滴加少量K3[Fe(CN)6]溶液,有蓝色沉淀出现,故B错误;
C.高温下,Fe与氧气反应生成四氧化三铁,该条件下,铁发生化学腐蚀,故C正确;
D.Fe、Mg构成原电池时,Mg的活泼性比Fe强,Mg失电子作负极,故D错误.
故选C.
点评 本题综合考查电化学知识,侧重于金属的腐蚀与防护以及原电池的工作原理的考查,题目难度不大,注意把握电极反应.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 32gO2和O3混合气体中所含的原子数目为2NA | |
| B. | 20℃时,铝的密度为2.7g•cm-3,则1个Al原子的体积为$\frac{22.4}{{N}_{A}}$cm3 | |
| C. | 标况下,NA个N2分子的体积约为22.4L,则1个N2分子的体积为$\frac{10}{{N}_{A}}$L | |
| D. | 0.5NA个氯气分子的物质的量是0.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将(CH3)3CCH2Cl与氢氧化钾的乙醇溶液加热一段时间后冷却,再滴加硝酸酸化的硝酸银溶液,可观察到有白色沉淀产生 | |
| B. | 新制氢氧化铜悬浊液可检验失去标签的乙醛、乙酸、乙酸乙酯(必要时可加热) | |
| C. | 在鸡蛋清溶液中分别加入饱和Na2SO4、CuSO4溶液,都会因盐析产生沉淀 | |
| D. | 向淀粉溶液中加稀硫酸,加热几分钟,冷却后加入新制氢氧化铜悬浊液,若加热后未见砖红色沉淀生成,说明淀粉未开始水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某物质灼烧时,焰色反应为黄色,则该物质一定是金属钠 | |
| B. | 与水反应生成酸的物质就是酸性氧化物 | |
| C. | 胶体:分散质颗粒直径在1nm~100nm之间的分散系,能产生丁达尔效应 | |
| D. | 物质的量:衡量物质微粒个数的单位 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验事实 | 结论 | |
| A | Cl2的水溶液可以导电 | Cl2是电解质 |
| B | 取某溶液少量,加入盐酸酸化的氯化钡溶液,出现白色沉淀 | 该溶液中可能含有SO42- |
| C | 取少量Fe(NO3)2试样加水溶解,加稀硫酸酸化,滴加KSCN溶液,溶液变为血红色 | 该Fe(NO3)2试样已经变质 |
| D | SO2通入硝酸钡溶液出现白色沉淀 | BaSO3不溶于强酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图为2012年第29届伦敦奥运会使用的火炬,火炬中的燃料是丙烷(燃烧热为2221.5kJ/mol).下列正确的是( )
如图为2012年第29届伦敦奥运会使用的火炬,火炬中的燃料是丙烷(燃烧热为2221.5kJ/mol).下列正确的是( )| A. | 丙烷燃烧的过程中,化学能全部转化为热能 | |
| B. | 丙烷燃烧的热化学方程式为:C3H8(g)+5O2(g)→3CO2(g)+4H20(g);△H=-2221.5 kJ•mol-1 | |
| C. | 丙烷燃烧的热化学方程式为:C3H8(g)+5O2(g)→3CO2(g)+4H20(l);△H=-2221.5 kJ•mol-1 | |
| D. | 1mol丙烷若先分解生成C、H2,然后C、H2再完全燃烧放出的特例小于2221.5kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
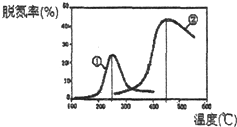 进入冬季北方开始供暖后,雾霾天气愈发严重,各地PM2.5、PM10经常“爆表”.引发雾霾天气的污染物中,最为常见的是机动车尾气中的氮氧化物和燃煤产生的烟气.
进入冬季北方开始供暖后,雾霾天气愈发严重,各地PM2.5、PM10经常“爆表”.引发雾霾天气的污染物中,最为常见的是机动车尾气中的氮氧化物和燃煤产生的烟气.时间/min 温度/℃ | 0 | 10 | 20 | 40 | 50 |
| T1 | 1.2 | 0.9 | 0.7 | 0.4 | 0.4 |
| T2 | 1.2 | 0.8 | 0.56 | … | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的结构简式:CH2CH2 | B. | 1-丁烯的键线式为: | ||
| C. | 苯的最简式为:C6H6 | D. | 丙烷分子的球棍模型示意图: |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com