
用物质的量都是0.1mol的CH3COOH和CH3COONa配制成1L混合溶液,已知其中c(CH3COO-)大于c(Na+)。对该混合溶液的下列判断正确的是( )
A、c(OH-)> c(H+) B、c(CH3COOH)+c(CH3COO-)=0.2mol/L
C、c(CH3COOH)>c(CH3COO-) D、c(CH3COO-)+c(OH-)=0.2mol/L
 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源:2016-2017学年山东省枣庄市北校区高一下学期第一次月考化学试卷(解析版) 题型:填空题
下表是元素周期表的一部分,列出11种元素在周期表中的位置,填写下列空白。

(1)第三周期元素中,原子半径最大的元素是(稀有气体除外)______,离子半径最小的是____(写元素符号)。
(2)J的简单离子的结构示意图__________。
(3)D、E、F、K四元素的最高价氧化物对应水化物,按碱性依次减弱顺序排列为(写化学式)____。
(4)比较G、H两元素的最高价氧化物对应水化物的酸性______(写化学式,下同)。比较C、G两元素的气态氢化物稳定性_________。
查看答案和解析>>
科目:高中化学 来源:2017届内蒙古赤峰市宁城县高三一模理科综合化学试卷(解析版) 题型:简答题
铁碳合金在现代建筑中占有十分重要的地位。

(1)基态Fe3+的M能层上电子排布式为_______,铁元素可形成多种配合物,如K3[Fe(CN)6]和Fe(CO)5,则这两种配合物所涉及的元素中,第一电离能由大到小的顺序为________,电负性最大的是_______。
(2)三聚氰胺( )中六元环结构与苯环类似,它与硝基苯的相对分子质量之差为3,三聚氰胺的熔点为354 ℃,硝基苯的熔点是5.7 ℃。
)中六元环结构与苯环类似,它与硝基苯的相对分子质量之差为3,三聚氰胺的熔点为354 ℃,硝基苯的熔点是5.7 ℃。
①三聚氰胺中,环上与环外的氮原子杂化轨道类型分别为_______。
②导致三聚氰胺与硝基苯熔点相差很大的根本原因是____________________。
(3)已知常温下草酸(HOOC—COOH)的电离平衡常数Ka1=5.6×10-2、Ka2=1.5×10-4,试从结构上解释Ka1、Ka2数值上的差异__________________。
(4)一定条件下,碳、氮两种元素可形成一种化合物,该化合物可作耐磨材料,其熔点________(填“高于”、“低于”或“无法判断”)金刚石的熔点。
(5)铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。则铁镁合金的化学式为________,若该晶胞的参数为dnm,则该合金的密度为____________(不必化简,用NA表示阿伏加德罗常数)。
查看答案和解析>>
科目:高中化学 来源:2016届湖南省高三2月模拟理科综合化学试卷(解析版) 题型:选择题
过碳酸钠( )在生产和生活领域应用广泛,其制备反应为:
)在生产和生活领域应用广泛,其制备反应为: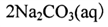
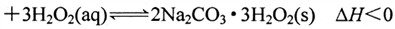 。过碳酸钠具有Na2CO3和H2O2的双重性质, 在500C时分解为碳酸钠和过氧化氢。下列有关说法错误的是
。过碳酸钠具有Na2CO3和H2O2的双重性质, 在500C时分解为碳酸钠和过氧化氢。下列有关说法错误的是
A. 实验室制备过碳酸钠时可釆用冷水浴控制反应温度
B. 过碳酸钠水溶液呈碱性,可用作漂洗剂和消毒杀菌剂
C. 过碳酸钠应密封保存,放置于冷暗处
D. 过碳酸钠可使酸性高锰酸钾溶液褪色,并放出一种无色气体
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二2月联考化学试卷(解析版) 题型:简答题
在100℃时,将0.40 mol二氧化氮气体充入一个1 L抽空的密闭容器中,发生反应:2NO2 N2O4。每隔一段时间就对该容器内的物质进行分析,得到下表数据:
N2O4。每隔一段时间就对该容器内的物质进行分析,得到下表数据:
时间/s | 0 | 20 | 40 | 60 | 80 |
n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
(1)在上述条件下,从反应开始至20 s时,用NO2表示的平均反应速率为_____________。
(2)该反应的平衡常数K的数值为___________(精确到0.1)。
(3)若在相同条件下最初向该容器中充入N2O4,要达到上述平衡状态,N2O4的起始浓度是______mol·L?1。
(4)上述(3)达到平衡后N2O4的转化率为_______,混合气体的平均摩尔质量为____________。
(5)达到平衡后,如果升高温度,气体颜色会变深,则升高温度后,反应2NO2 N2O4的平衡常数将________(填“增大”“减小”或“不变”)。
N2O4的平衡常数将________(填“增大”“减小”或“不变”)。
(6)达到平衡后,如果向该密闭容器中再充入0.32 mol He,并把容器体积扩大为4 L,则平衡将_____(填“向左移动”“向右移动”或“不移动”)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二2月联考化学试卷(解析版) 题型:选择题
t℃时,在一密闭容器中充入2mol A和3mol B,发生如下化学反应:aA+B C+B(反应物、产物均为气体)平衡后测知各物质浓度有如下关系:{c(A)}a·c(B)=c(C)·c(D)然后在温度不变的情况下,扩大容器容积至原来10倍,结果A的百分含量始终未有改变,则这时B的转化率是
C+B(反应物、产物均为气体)平衡后测知各物质浓度有如下关系:{c(A)}a·c(B)=c(C)·c(D)然后在温度不变的情况下,扩大容器容积至原来10倍,结果A的百分含量始终未有改变,则这时B的转化率是
A.60% B.40% C.50% D.无法确定
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二2月联考化学试卷(解析版) 题型:选择题
为了除去硫酸铜溶液中含有的Fe2+杂质,先加入合适的氧 化剂使Fe2+氧化为Fe3+,下列物质中最好选用
化剂使Fe2+氧化为Fe3+,下列物质中最好选用
A. Cl2水 B. H2O2溶液 C. KMnO4溶液 D. HNO3溶液
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省枣庄市南校区高一3月月考化学试卷(解析版) 题型:选择题
X、Y、Z是3种短周期元素,其中X、Y位于同一主族,Y、Z处于同一周期。X原子的最外层电子数是其电子层数的3倍。Z原子的核外电子数比Y原子少1。下列说法正确的是( )
A. 元素非金属性由弱到强的顺序为Z<Y<X
B. Y元素最高价氧化物对应水化物的化学式可表示为H3YO4
C. 3种元素的气态氢化物中,Z的气态氢化物最稳定
D. 原子半径由大到小的顺序为Y>Z>X
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高一下学期第一次月考化学试卷(解析版) 题型:选择题
下列关于元素周期律叙述正确的是
A. 随着元素原子序数的递增,原子最外层电子数总是从1到8地重复出现
B. 元素的性质随着原子序数的递增而呈周期性的变化
C. 随着元素的原子序数的递增,元素的最高正价从+1到+7,负价从-7到-1地重复出现
D. 元素性质的周期性变化是指原子核外电子排布的周期性变化、原子半径的周期性变化及元素主要化合价的周期性变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com