
 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����6�֣���1����֪CH4(g)+2O2 (g) = CO2 (g) +2H2O(l); ��H=-890kJ/mol,����CH4��CO��0.75mol,��ȫȼ�պ�����CO2�����18gҺ̬ˮ�����ų�515kJ��������COȼ�յ��Ȼ�ѧ����ʽΪ ��
��2����ѧ��ӦN2+3H2![]() 2NH3�������仯��ͼ��ʾ��д�����ɰ���ʱ�÷�Ӧ���Ȼ�ѧ����ʽ ��
2NH3�������仯��ͼ��ʾ��д�����ɰ���ʱ�÷�Ӧ���Ȼ�ѧ����ʽ ��
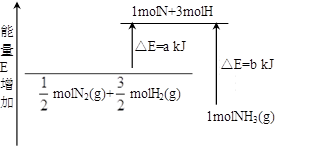
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013������˲���ѧУ�߶���ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
���б�ʾ��ѧ���̵Ļ�ѧʽ��д��ȷ���ǣ�
A������������Һ�Լ��ԣ�SO32��+2 H2O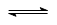 H2SO3 +2 OH��
H2SO3 +2 OH��
B���Ȼ���Ͷ��ˮ�к���ƽ�⣺AgCl (s) 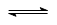 Ag+ (aq) + Cl��(aq)
Ag+ (aq) + Cl��(aq)
C�������ȼ����Ϊ890.3kJ��mol-1����ʾ����ȼ���ȵ��Ȼ�ѧ����ʽΪ��
CH4(g)+2O2(g)��CO2(g)+2H2O(g) ��H=��890.3kJ��mol-1
D��500�桢30MPa�£���0.5mol
N2��1.5molH2�����ܱյ������г�ַ�Ӧ����NH3(g)������19.3kJ���Ȼ�ѧ����ʽΪ��N2(g)+3H2(g)
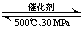 2NH3(g) ��H=��38.6 kJ��mol-1
2NH3(g) ��H=��38.6 kJ��mol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010-2011ѧ�꽭��ʡ�ϲ��и���12���¿���ѧ�Ծ� ���ͣ�ѡ����
�����Ȼ�ѧ����ʽ�����ӷ���ʽ�У���ȷ���ǣ�
A.�����ȼ����Ϊ890.3kJ��mol-1�������ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪ����CH4(g)+2O2(g)=CO2(g)+2H2O(g) ��H=-890.3kJ��mol-1
B. 500�桢30MPa�£���0.5mol N2��1.5molH2�����ܱյ������г�ַ�Ӧ����NH3(g)������19.3kJ�����Ȼ�ѧ����ʽΪ��
 ��H=-38.6kJ��mol-1
��H=-38.6kJ��mol-1
C. �Ȼ�þ��Һ�백ˮ��Ӧ��
D. ����������NaOH��Һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2009-2010ѧ���ij����и߶��ڶ�ѧ�ڵ��Ĵν��Բ��Ի�ѧ���� ���ͣ�ѡ����
��¯ұ������������ͼ��ʹ��Ȼ�������������������������ȼ������ʹ��������Ȼ��ȼ��CH4(g)+2O2(g)=CO2(g)+2H2O(g)������Ӧ�ҷ����ķ�ӦΪ��CH4(g)+H2O(g) 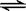 CO(g)+3H2(g) ∆H1=+216kJ/mol��CH4(g)+ CO2(g)
CO(g)+3H2(g) ∆H1=+216kJ/mol��CH4(g)+ CO2(g)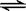 2CO(g) + 2H2(g) ∆H2=+260kJ/mol������������ƽ��Ĵ��ڣ�������˵����ȷ����
2CO(g) + 2H2(g) ∆H2=+260kJ/mol������������ƽ��Ĵ��ڣ�������˵����ȷ����
A���������Ӧ�ҵ�ѹǿ�������ת���ʼ�С
B��������ά����550��750�棬Ŀ�Ľ������CH4ת��������
C������ȼ���ҵ���ҪĿ���Dz���CO2��ˮ������ԭ��������鷴Ӧ
D��������Ӧ���У��ﵽƽ��ʱ��������n(CH4)=amol/L,n(CO)=bmol/L
n(H2)=cmol/L,��ͨ�����Ӧ�ҵ�CH4�����ʵ���Ϊa+(b+c)/4
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com