
分析 (1)反应速率越大,反应达到平衡消耗的时间越短;根据能使平衡正向移动的条件来回答;
(2)A容器容积不变,B容器压强不变,在450℃下开始反应,随着反应的进行,生成的气体的物质的量逐渐增加,恒容容器中压强增大,相当于在恒压容器中的基础上加压,据此回答.
解答 解:(1)A中反应经过10min后达到平衡,B中反应在第12min时达到平衡.所以反应从开始达到平衡时间段内反应速率v(A)>v(B),第15min时改变A容器中的某种反应条件后,平衡向右移动且NO的浓度增大,则改变的条件可能是降低温度或增加体积,故答案为:>;降低温度或增加体积;
(2)A容器容积不变,B容器压强不变,在450℃下开始反应,随着反应的进行,生成的气体的物质的量逐渐增加,恒容容器中压强增大,相当于在恒压容器中的基础上加压,两个容器中压强大小关系为PA>B,增大压强,平衡逆向移动,所以水的含量降低,即达到平衡时两个容器中H2O百分含量较高的容器是B,故答案为:>;B.
点评 本题考查学生影响化学反应速率和平衡移动的因素等方面的知识,注意知识的归纳和梳理是关键,难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:3 | B. | 1:2 | C. | 2:3 | D. | 3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
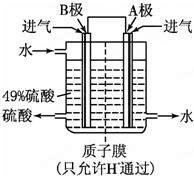 硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制备绿矾.
硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制备绿矾.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com