
| t1~t2 | t3~t4 | t4~t5 | t6~t7 |
| K1 | K2 | K3 | K4 |
| 物质 | CO2 | CH4 | CO | H2 |
| 浓度(mol•L-1) | 1 | 1 | 1 | 1 |
分析 (1)正反应为熵增的反应,△G=△H-T△S<0反应自发进行;
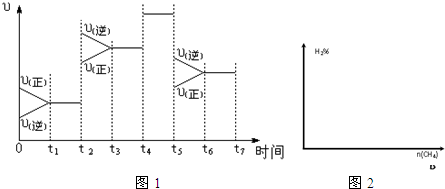
(2)t1~t2处于平衡状态,t2时刻改变条件后,瞬间v正、v逆都增大,且v逆>v正,平衡逆向移动,正反应为气体体积增大的吸热反应,不能是升高温度,改变条件只能是增大压强,温度不变,平衡常数不变化,故K1=K2;
t4时刻改变条件,正逆反应速率都增大,但平衡不移动,故t4时刻所改变的条件是使用催化剂,平衡常数不变,K3=K2;
t5时刻改变条件,正逆反应速率都减小,且v逆>v正,平衡逆向移动,不能是降低压强,改变的条件为降低温度,故K3>K4;
(3)H2的体积分数随投料比[n(CH4)/n(CO2)]的增大而增大,当体积比是3的时候,氢气的体积分数最大,如下图所示:
(4)①3分钟后达平衡,测得CH4体积分数为25%,CO2转化率为α,则:
CO2(g)+CH4(g)?2CO(g)+2H2(g)
起始量(mol):1 1
变化量(mol):α α 2α 2α
平衡量(mol):1-α 1-α 2α 2α
根据体积分数方程式计算转化率,再根据v=$\frac{△c}{△t}$计算v(H2);
②其他条件不变,改为加入3mol CO2、3mol CH4,等效为在原平衡的基础上增大压强,平衡逆向移动,平衡时CO2的转化率减小;
③根据K=$\frac{{c}^{2}(CO)×{c}^{2}({H}_{2})}{c(C{O}_{2})×c(C{H}_{4})}$计算平衡常数,再计算浓度商Qc,与平衡常数相比判断反应进行方向.
解答 解:(1)正反应为气体物质的量增大的反应,则正反应为△S>0,而△H>0,反应自发进行,△G=△H-T△S<0,故高温下具有自发性,故选:②;
(2)t1~t2处于平衡状态,t2时刻改变条件后,瞬间v正、v逆都增大,且v逆>v正,平衡逆向移动,正反应为气体体积增大的吸热反应,不能是升高温度,改变条件只能是增大压强,温度不变,平衡常数不变化,故K1=K2;
t4时刻改变条件,正逆反应速率都增大,但平衡不移动,故t4时刻所改变的条件是使用催化剂,平衡常数不变,K3=K2;
t5时刻改变条件,正逆反应速率都减小,且v逆>v正,平衡逆向移动,不能是降低压强,改变的条件为降低温度,故K3>K4,
综上分析可知,平衡常数:K1=K2=K3>K4,
故答案为:K1=K2=K3>K4;
(3)H2的体积分数随投料比[n(CH4)/n(CO2)]的增大而增大,当投料比等于化学计量之比13时,平衡体系中氢气的体积分数最大,平衡时H2百分含量的变化曲线: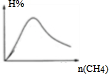 ,故答案为:
,故答案为: ;
;
(4)①3分钟后达平衡,测得CH4体积分数为25%,CO2转化率为α,则:
CO2(g)+CH4(g)?2CO(g)+2H2(g)
起始量(mol):1 1 0 0
变化量(mol):α α 2α 2α
平衡量(mol):1-α 1-α 2α 2α
则$\frac{2α}{1-α+1-α+2α+2α}$=25%,解得α=$\frac{1}{3}$=0.33,
v(H2)=$\frac{\frac{2×\frac{1}{3}mol}{1L}}{3min}$=0.22mol/(L.min),
故答案为:0.22;0.33;
②其他条件不变,改为加入3mol CO2、3mol CH4,等效为在原平衡的基础上增大压强,平衡逆向移动,平衡时CO2的转化率减小,即小于α,故答案为:小于;
③容器的体积为1L,利用物质的量代替浓度计算平衡常数,则K=$\frac{{c}^{2}(CO)×{c}^{2}({H}_{2})}{c(C{O}_{2})×c(C{H}_{4})}$=$\frac{(\frac{2}{3})^{2}×(\frac{2}{3})^{2}}{\frac{2}{3}×\frac{2}{3}}$=$\frac{4}{9}$,而浓度商Qc=1>K,故反应向逆反应进行,则放出热量,
故答案为:放出.
点评 本题考查化学平衡计算、化学平衡影响因素、平衡常数等,要求学生熟练掌握基础知识,具有分析和解决问题的能力,难度中等.


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制备绿矾.
硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制备绿矾.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 | 氯化钙 |
| 水中的溶解性 | 可溶于冷水易溶于热水 | 可溶 | 易溶 | 易溶 |
| 乙醇中的溶解性 | 微溶 | 微溶 | 可溶 | 可溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 2min | 4min | 6min | 8min | … | |
| CO | 0.07 | 0.06 | 0.06 | 0.05 | … |
| H2 | x | 0.12 | 0.12 | 0.2 | … |
| CH3OH | 0.03 | 0.04 | 0.04 | 0.05 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
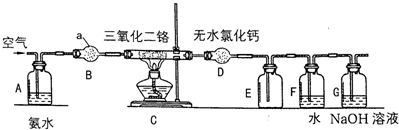
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com