
【题目】下列关于葛根素( )的说法,正确的是
)的说法,正确的是
A.0.1 mol 葛根素完全燃烧,生成 22.4L(标准状况)H2O
B.1mol 葛根素与溴水反应,最多消耗 2.5mol Br2
C.一定条件下,葛根素能发生氧化、消去及水解等反应
D.与足量 H2 发生加成反应,该分子中官能团的种类减少 2 种
【答案】D
【解析】
A.1个葛根素分子中有20个H, 0.1 mol 葛根素完全燃烧,能生成1mol水,但在标准状况下,水不是气体,所以生成的水在标准状况下的体积不是22.4L,A错误;
B.葛根素分子中有酚羟基,在酚羟基的邻对位碳原子上的氢原子可以被溴原子取代,葛根素分子中还有碳碳双键,可以和溴发生加成反应,所以1mol 葛根素与溴水反应,最多消耗 4mol Br2,B错误;
C.葛根素分子中有羟基,能发生氧化和消去反应,但没有酯基、卤素原子和肽键等,所以不能发生水解反应,C错误;
D.葛根素分子中的苯环、羰基和碳碳双键都可以和氢气加成,葛根素与足量 H2 发生加成反应后,羰基转变为羟基,碳碳双键变成碳碳单键,所以分子中官能团的种类减少 2 种,D正确;
故选D。


科目:高中化学 来源: 题型:
【题目】草酸合铁酸钾晶体Kx[Fe(C2O4)y]·3H2O是一种光敏材料,下面是一种制备草酸合铁酸钾晶体的实验流程。

已知:(NH4)2SO4、FeSO4·7H2O、莫尔盐[(NH4)2SO4·FeSO4·6H2O]的溶解度如表:
温度/℃ | 10 | 20 | 30 | 40 | 50 |
(NH4)2SO4/g | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 |
FeSO4·7H2O/g | 40.0 | 48.0 | 60.0 | 73.3 | ― |
(NH4)2SO4·FeSO4·6H2O/g | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 |
(1)废铁屑在进行“溶解1”前,需用在5% Na2CO3溶液中加热数分钟,并洗涤干净。Na2CO3溶液的作用是________。
(2)“溶解1”应保证铁屑稍过量,其目的是___________。“溶解2”加“几滴H2SO4”的作用是________。
(3)“复分解”制备莫尔盐晶体的基本实验步骤是:蒸发浓缩、________、过滤、用乙醇洗涤、干燥。用乙醇洗涤的目的是____________。
(4)“沉淀”时得到的FeC2O4·2H2O沉淀需用水洗涤干净。检验沉淀是否洗涤干净的方法是_______。
(5)“结晶”应将溶液放在黑暗处等待晶体的析出,这样操作的原因是__________。
(6)请补全测定草酸合铁酸钾产品中Fe3+含量的实验步骤[备选试剂:KMnO4溶液、锌粉、铁粉、NaOH溶液:
步骤1:准确称取所制备的草酸合铁酸钾晶体a g,配成250 mL待测液。
步骤2:用移液管移取25.00 mL待测液于锥形瓶中,加入稀H2SO4酸化,_________,C2O42-转化为CO2被除去。
步骤3:向步骤2所得溶液中______________。
步骤4:用c mol·L-1 KMnO4标准溶液滴定步骤3所得溶液至终点,消耗V mL KMnO4标准溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸铈铵、磷酸锰铵是两种重要的复盐,在工农业生产中具有广泛应用。
(1) 复盐是由两种或两种以上金属离子(或铵根离子)和一种酸根离子构成的盐。下列物质属于复盐的是________(填序号)。
A.BaFe2O4 B.NaHSO4 C.KAl(SO4)2·12H2O D.Ag (NH3)2OH
(2) 硝酸铈铵[(NH4)2Ce(NO3)6]的制备方法如下:
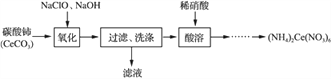
①“氧化”得到CeO2的化学方程式为________________________________。
②证明CeO2已经洗涤干净的方法是_____________________________。
(3) 为测定磷酸锰铵[(NH4)aMnb(PO4)c·xH2O]的组成,进行如下实验:①称取样品2.448 0 g,加水溶解后配成100.00 mL溶液A;②量取25.00 mL溶液A,加足量NaOH溶液并充分加热,生成NH3 0.067 20 L(标准状况);③另取25.00 mL溶液A,边鼓空气边缓慢滴加氨水,控制溶液pH 6 ~ 8,充分反应后,将溶液中Mn2+转化为Mn3O4,得Mn3O4 0.2290 g。通过计算确定该样品的化学式(写出计算过程) __________。
查看答案和解析>>
科目:高中化学 来源: 题型:
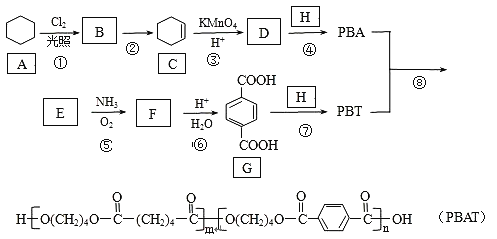
【题目】PBAT(聚己二酸对苯二甲酸丁酯)可被微生物几乎完全降解,成为包装、医疗和农用薄膜等领域的新兴材料,它可由聚合物PBA和PBT共聚制得,一种合成路线如下:
已知:R—CH3![]() R—CN
R—CN![]() R—COOH
R—COOH
R-CH=CH2![]() R-COOH+CO2
R-COOH+CO2
回答下列问题:
(1)G的官能团的名称为________。
(2)①的反应类型为___________;反应②所需的试剂和条件是___________。
(3)D的结构简式为___________;H的化学名称为___________。
(4)⑤的化学方程式为______________。
(5)M与G互为同系物,M的相对分子质量比G大14;N是M的同分异构体,写出同时满足以下条件的N的结构简式:___________(写两种,不考虑立体异构)。
Ⅰ、既能与FeCl3发生显色反应,又能发水解反应和银镜反应;
Ⅱ、与NaOH溶液反应时,1mol N能消耗4molNaOH;
Ⅲ、核磁共振氢谱有五组峰,峰面积比为1:2:2:2:1。
(6)设计由丙烯为起始原料制备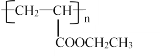 的单体的合成路线(其它试剂可任选)____________。
的单体的合成路线(其它试剂可任选)____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】囧烷(E)的一种合成路线如图:

(1)A→B的反应类型为_____;
(2)E的分子式_____;A可用于合成一种重要的合成橡胶的单体,写出由A制备该单体的化学方程式为_____。
(3)满足下列条件的D的所有同分异体的结构简式为_____。
Ⅰ.含有1个苯环,无其它环状结构,能与FeCl3溶液发生显色反应。
Ⅱ.核磁共振氢谱有4组峰且面积比为3:3:2:2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,10mL0.40molL-1H2O2在MnO2作用下发生反应 :2H2O2 ( aq)=2H2O(l )+O2( g) △H <0, 不同时刻测定生成O2的物质的量如下表所示 :
t/min | 0 | 3 | 6 | 10 | ……. |
n(O2)/mol | 0.0 | 0.0008 | 0.001 | 0.0012 | ……. |
下列叙述不正确的是(溶液体积变化忽略不计)
A.升高温度,可加快H2O2 的分解速率
B.若增大溶液起始浓度,则收集到 0.0 008 mol O2 的时间会小于3 min
C.反应至 6min 时,溶液 中 c(H2O2)=0.2mol L-1
D.反应至 12min 时,H2O2分解率为 65%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CaCl2固体遇 NH3会形成 CaCl2 8 NH3(可溶于水)。下列说法不正确的是
A.CaCl2 作干燥剂时,不能干燥 NH3
B.CaCl2 8 NH3溶于水,溶液呈中性
C.CaCl2 8 NH3溶于水,通少量CO2 会产生白色沉淀
D.CaCl2 与 NH3形成CaCl2 8 NH3的过程属于化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.![]() 的名称为2-乙基丁烷
的名称为2-乙基丁烷
B.35Cl和37Cl 互为同素异形体
C.![]() 经催化加氢后能生成2-甲基戊烷
经催化加氢后能生成2-甲基戊烷
D.CH3CH2COOH和HCOOCH3互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中,由CO合成甲醇:CO(g)+2H2(g)![]() CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是
CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是
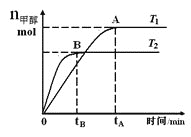
A. 平衡常数K=![]()
B. 该反应在T1时的平衡常数比T2时的小
C. CO合成甲醇的反应为吸热反应
D. 处于A点的反应体系从T1变到T2,达到平衡时![]() 增大
增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com