
A.0.100 mol·L-1 B.0.0500 mol·L-1
C.0.200 mol·L-1 D.0.400 mol·L-1
科目:高中化学 来源: 题型:阅读理解
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.2 |
| Cr3+ | 6.0 | 8.0 |
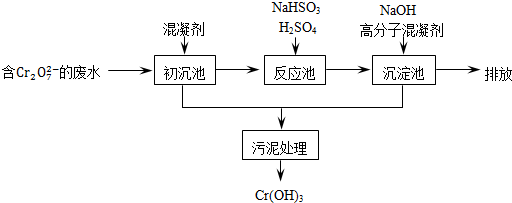
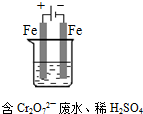
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 物质 | FeSO4 | H2SO4 | Ag2SO4 | Al2(SO4)2 | 污泥 |
| 质量分数/(%) | 15.0 | 7.0 | 0.40 | 0.34 | 5.0 |
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 |
| FeSO4溶液度(g) | 15.6 | 20.5 | 26.5 | 32.9 | 40.2 | 48.6 |
| Al2(SO4)3溶解度(g) | 31.2 | 33.5 | 36.4 | 40.4 | 45.7 | 52.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 温度/℃ 溶解度/g 盐 |
0 | 10 | 20 | 30 | 40 | 50 | 60 |
| (NH4)2SO4 | 70.6 | 73.0 | 75.4 | 78.0 | 81.0 | - | 88.0 |
| FeSO4?7H2O | 15.7 | 20.5 | 26.5 | 32.9 | 40.2 | 48.6 | - |
| (NH4)SO4FeSO4?6H2O | 12.5 | 17.2 | 21.6 | 28.1 | 33.0 | 40.0 | - |
| 起始铁的质量m1/g | 反应后铁的质量m2/g | 莫尔盐的质量 | 产率 | |
| 理论产量/g | 实际产量m3/g | |||
| 5.0 | 2.2 | c | 14.7 | d |
查看答案和解析>>
科目:高中化学 来源:江苏省盐城市2010届高三第二次调研考试化学试题 题型:022
钢铁工业在我国国民经济中处于十分重要的位置,工业上采用高炉冶炼,常用赤铁矿、焦炭、空气和熔剂(石灰石)作原料.已知赤铁矿被还原剂还原时是逐级进行的,还原时温度及CO、CO2平衡混合气体中CO的体积分数的关系如下图:

(1)铁在元素周期表中位于________周期________族
(2)在温度低于570℃时,还原分两阶段完成,在温度高于570℃时,依次发生的还原反应有:________(选用上图中的a、b、c、d填空)
(3)为减少高炉冶铁时,含CO的尾气排放,下列研究方向不可取的是________.
(a)其它条件不变,增加高炉的高度
(b)调节还原时的炉温
(c)增加原料中焦炭与赤铁矿的比例
(d)将生成的铁水及时移出
(4)已知下列反应数值:

反应④ΔH4=________kJ·mol-1.
(5)1100℃时,FeO(s)+CO(g)![]() Fe(s)+CO2(g),平衡常数K=0.4.今在一密闭容器中,加入7.2 g FeO,同时通入4.48 L CO(已折合为标准状况),将其升温到1100℃,并维持温度不变,达平衡时,FeO的转化率为:________.
Fe(s)+CO2(g),平衡常数K=0.4.今在一密闭容器中,加入7.2 g FeO,同时通入4.48 L CO(已折合为标准状况),将其升温到1100℃,并维持温度不变,达平衡时,FeO的转化率为:________.
查看答案和解析>>
科目:高中化学 来源:2013-2014学年四川省绵阳市高三第二次诊断性考试理综化学试卷(解析版) 题型:选择题
将11.9 g Mg、Al、Fe组成的合金溶于足量NaOH溶液中,产生的气体在标准状况下体积为3.36 L。另取等质量合金溶于过量稀硝酸中,生成NO气体,向反应后的溶液中加入过量NaOH溶液,得到沉淀19.4 g,则上述反应中生成NO气体的体积为(标准状况下)
A.6.72 L B.11.2 L C.22.4 L D.4.48 L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com