
将100gNa2CO3和NaHCO3的混合物用酒精灯加热至质量不再变化时,固体质量减少到75.2g。此混合物中Na2CO3的质量分数是( )
A. 75.2% B. 67.2% C. 41.7% D. 32.8%
 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源:2017届河北省高三上学期期末考试理综化学试卷(解析版) 题型:简答题
碲(Te)为第VIA元素.其单质和化合物在化工生产等方面具有重要应用。
(1)TeO2微溶于水,易溶于较浓的强酸和强碱。与盐酸反应时生成四氯化碲,其化学方程式为________________。
(2)25℃时;亚碲酸(H2TeO3)的 Ka1=1×10-3,Ka2=2×10-8。该温度下,0.1mol·L-1 H2TeO3的电离度α约为______________(α= ×100%);NaHTeO3溶液的pH__________7(填“ >”、“<”或“=”)。
×100%);NaHTeO3溶液的pH__________7(填“ >”、“<”或“=”)。
(3)工业上常用铜阳极泥(主要成分为Cn2Te,还含有少量的Ag、Au)为原料制备单质碲,其工艺流程如下:
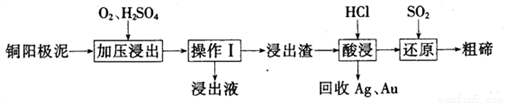
①实验室进行操作I时,下列仪器与该实验操作无关的为__________(填选项字母)。
A.长颈漏斗 B.烧杯 C.锥形瓶 D .玻璃棒
②已知‘浸出渣”的主要成分为TeO2。“加压浸出”时控制溶液pH为4.5~5.0,酸性不能过强的原因为_______________;“加压浸出”过程的离子方程式为______________________。
③“酸浸”后将SO2通入浸出液即可制得单质碲,则生成碲的化学方程式为________________。
④工业上还可以将铜阳极泥煅烧、碱浸后得到Na2TeO3,然后通过电解的方法得到单质碲。已知电解时的电极均为石墨,则阴极的电极反应式为___________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省景德镇市高二(素质班)上学期期末考试化学试卷(解析版) 题型:选择题
下列反应在一定条件下可以实现的是( )
①酸性氧化物与碱反应 ②有单质参加的非氧化还原反应
③没有水生成,也没有沉淀和气体生成的复分解反应
④两种酸溶液充分反应后的溶液呈中性
A. 1个 B. 2个 C. 3个 D. 4个
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省庄河市高一上学期期末考试化学试卷(解析版) 题型:选择题
一定条件下,24mL的CO2和N2的混合气体通过足量的过氧化钠粉末,充分反应后得到相同状况下的气体20ml,则原混合气体中CO2的体积分数为( )
A. 33.3% B. 44% C. 56% D. 66.7%
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省庄河市高一上学期期末考试化学试卷(解析版) 题型:选择题
下列化合物中,可以通过置换反应一步得到的是( )
①FeSO4 ②NaOH ③Fe3O4 ④Al2O3
A. ①②③④ B. ①②③ C. ①④ D. ①③
查看答案和解析>>
科目:高中化学 来源:2017届广西省高三2月份模拟演练理综化学试卷(解析版) 题型:推断题
工业上以1,3-丁二烯、丙烯、乙炔等为原料合成 ,流程图如下:
,流程图如下:


(1)反应①的反应类型是________,B中含有的官能团的名称__________。
(2)写出反应②的化学方程式___________。
(3)写出C的结构简式_________。
(4)写出 含有六元环且核磁共振氢谱有4组峰的同分异构体的结构简式________。
含有六元环且核磁共振氢谱有4组峰的同分异构体的结构简式________。
(5)据以上合成信息,以乙烯为原料合成1,6-乙二醇,其他试剂任选,写出合成的流程图______。
查看答案和解析>>
科目:高中化学 来源:2017届广西省高三2月份模拟演练理综化学试卷(解析版) 题型:选择题
常温下,0.1000mol·L-1NaOH溶液分别滴定20.00mL浓度均为0.1000mol·L-1的两种一元酸HX、HY溶液,滴定曲线如图所示。下列说法正确的是

A. HX是强酸,HY是弱酸
B. V[NaOH(aq)]=10.00mL时,
C. V[NaOH(aq)]=20.00mL时,所得的两种溶液的pH均等于7
D. V[NaOH(aq)]=20.00mL时,所得的两种溶液的导电性,HX的比HY的强
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省盐城市高二学业水平模拟(一)化学试卷(解析版) 题型:简答题
KIO3是一种无色易溶于水的晶体,医药上可作防治地方甲状腺肿的药剂,目前碘酸钾被广泛应用于食盐加碘。一种由含碘废水制取碘酸钾的工艺如下:

(1) 检验“含碘废水”中含有的单质I2,常用的试剂是________。
(2) 进行“过滤1”时,需同时对CuI沉淀进行洗涤。在洗涤过滤滤液中可通过滴加________盐溶液来检验其是否已洗涤干净。
(3) “滤渣2”的成分为____________(填化学式)。
(4) “制KI”时,发生反应的化学方程式为____________。
(5) 江苏食用加碘盐新标准是每千克食盐中碘元素含量为25毫克(波动范围为18~33 mg/kg)。测定食盐试样中碘元素含量的步骤如下:称取4.000 g市售食盐加入锥形瓶中,依次加入适量的水、稍过量KI及稀硫酸;充分反应后,再加入12.00 mL 6.000×10-4 mol·L-1 Na2S2O3溶液,与生成的碘恰好完全反应。有关反应原理为:
KIO3+5KI+3H2SO4===3K2SO4+3I2+3H2O; I2+2S2O ===2I-+S4O
===2I-+S4O 。
。
①计算该食盐试样中碘元素的含量(单位mg/kg,写出计算过程)。
_______
②该食盐试样是否符合江苏食用加碘盐新标准并说明判断依据。
_______
查看答案和解析>>
科目:高中化学 来源:2017届河南省南阳、信阳等六市高三第一次联考理综化学试卷(解析版) 题型:简答题
为有效控制雾霾,各地积极采取措施改善大气质量,有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要。
(1)在汽车排气管内按照催化转化器,可将汽车尾气中主要污染物转化为无毒的大气循环物质。
已知:① N2(g)+O2(g)=2NO(g) △H=+180.5kJ·mol-1
②C和CO的燃烧热(△H)分别为-393.5kJ·mol-1和-283kJ·mol-1
则2NO(g)+2CO(g)=N2(g)+2CO2(g)) △H=_______kJ·mol-1
(2)将0.20molNO和0.10molCO充入一个容积为1L的密闭容器中,反应过程中物质浓度变化如图所示。
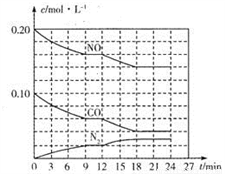
①CO在0-9min内的平均反应速率v(CO)=________mol·L-1·min-1 (保留两位有效数字);第12 min时改变的反应条件可能为________。
A.升高温度 B.加入NO C.加催化剂 D.降低温度
②该反应在第18 min时达到平衡状态,CO2的体积分数为________(保留三位有效数字),化学平衡常数K=________(保留两位有效数字)。
(3)通过人工光合作用能将水与燃煤产生的CO2转化成HCOOH和O2。已知常温下0.1mol·L-2的
HCOONa溶液pH=10,则HCOOH的电离常数Ka=______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com