
【题目】碳族元素的单质和化合物在化工、医药、材料等领域有着广泛的应用。
(1)锗是重要半导体材料,基态Ge原子中,核外电子占据最高能级的符号是______,该能级的电子云轮廓图为________。Ge的晶胞结构与金刚石类似,质地硬而脆,沸点2830℃,锗晶体属于_______晶体。
(2)(CH3)3C+是有机合成重要中间体,该中间体中碳原子杂化方式为_______,(CH3)3C+中碳骨架的几何构型为________。
(3)治疗铅中毒可滴注依地酸钠钙,使Pb2+转化为依地酸铅盐。下列说法正确的是_______。
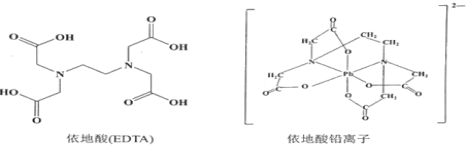
A.形成依地酸铅离子所需n(Pb2+)∶n(EDTA)=1∶4
B.依地酸中各元素的电负性从大到小的顺序为O>N>C>H
C.依地酸铅盐中含有离子键和配位键
D.依地酸具有良好的水溶性是由于其分子间能形成氢键
(4)下表列出了碱土金属碳酸盐的热分解温度和阳离子半径:
碳酸盐 | MgCO3 | CaCO3 | SrCO3 | BaCO3 |
热分解温度/℃ | 402 | 900 | 1172 | 1360 |
阳离子半径/pm | 66 | 99 | 112 | 135 |
碱土金属碳酸盐同主族由上到下的热分解温度逐渐升高,原因是:__________。
(5)有机卤化铅晶体具有独特的光电性能,下图为其晶胞结构示意图:
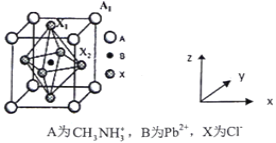
①若该晶胞的边长为anm,则Cl-间的最短距离是________。
②在该晶胞的另一种表达方式中,若图中Pb2+处于顶点位置,则Cl-处于____位置。
【答案】4p 纺锤形或哑铃形 原子 sp2 sp3 平面三角形 BC 金属阳离子半径越大,金属氧化物晶格能越小,氧化物越不稳定,碳酸盐越难分解 ![]() anm 棱心
anm 棱心
【解析】
(1)由于锗是第四周期第IVA元素所以其价层电子排布式是[Ar]4s24p2,最高能级符号及不同能级电子云形状;利用原子晶体熔沸点高、硬度大判断其晶体类型;
(2)甲基中碳原子形成4个σ键,另外碳原子形成3个σ键,均没有孤电子对,杂化轨道数目分别为4、3;根据与甲基C原子连接的C原子确定碳骨架的形状;
(3)A.形成依地酸铅离子所需n(Pb2+):n(EDTA)=1:2
B.非金属性越强,电负性越大;
C.内界配离子与外界酸根离子之间形成离子键、内界Pb2+与配体EDTA的离子形成配位键;
D.依地酸具有良好的水溶性,是由于其分子与水分子之间形成氢键;
(4)从表格中得出:这些物质的阴离子是相同的,均为碳酸根,阳离子的半径越大,分解温度越高;
(5)①晶胞中两个O原子的距离为晶胞参数的![]() ;
;
②根据图示可知若Pb2+处于顶点位置,则Cl-处于棱心上。
(1)根据锗是第四周期第IVA元素分析其最高能级符号是4p,由于p电子的电子云是纺锤形或哑铃形;Ge的晶胞结构与金刚石类似,质地硬而脆,沸点2830℃,由于金刚石是原子晶体,可知锗晶体属于原子晶体;
(2)甲基中碳原子形成4个σ键,另外碳原子形成3个σ键,均没有孤电子对,杂化轨道数目分别为4、3,分别采取sp3、sp2杂化;由于与三个甲基连接的C原子是采用sp2杂化,所以可确定C骨架为平面三角形;
(3)A.由配离子结构,可知形成依地酸铅离子所需n(Pb2+):n(EDTA)=1:2,A错误;
B.非金属性越强,电负性越大,由于元素的非金属性:O>N>C>H,所以元素的电负性O>N>C>H,B正确;
C.内界配离子与外界酸根离子之间形成离子键、内界Pb2+与配体EDTA的离子形成配位键,C正确;
D.依地酸具有良好的水溶性,是由于其分子与水分子之间形成氢键,D错误,
故合理选项是BC;
(4)碳酸盐的热分解是由于晶体中的阳离子结合碳酸根中的氧离子,使碳酸根分解为二氧化碳分子的结果,钙离子由于半径小和氧离子结合更为容易,氧化钙晶格能大,所以碳酸钙分解温度低;
(5)①根据图示可知晶胞中两个O原子的距离为晶胞参数的![]() ,由于晶胞参数为anm,所以晶胞中两个O原子的距离为
,由于晶胞参数为anm,所以晶胞中两个O原子的距离为![]() anm;
anm;
②根据图示可知若Pb2+处于顶点位置,则Cl-处于棱心上。


 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:
【题目】某温度时,在 一个2 L的密闭容器中,X、Y、Z三种物 质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
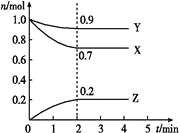
(1)该反应的化学方程式为 _________________。
(2)从开始至2 min,Z的平均反应速率为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述符合的是

A. 用甲实线、虚线分别表示某可逆反应未使用催化剂和使用催化剂的正、逆反应速率随时间的变化
B. 图乙表示反应2SO2(g)+O2(g)![]() 2SO3(g)△H<0的平衡常数K与温度和压强的关系
2SO3(g)△H<0的平衡常数K与温度和压强的关系
C. 图丙表示向0.1mol/L的NH4Cl溶液中滴加0.1mol/L的HCl溶液时,溶液中![]() 随HCl溶液体积变化关系
随HCl溶液体积变化关系
D. 图丁表示常温下向20mL pH=3的醋酸中滴加pH=11的NaOH溶液,溶液的pH随NaOH溶液体积的变化关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下图的说法不正确的是

A. 1 mol I2(s)与1 mol H2(g)化合生成2 mol HI(g)气体时,需要吸收5 kJ的能量
B. 2 mol HI(g)分解生成1 mol I2(g)与1 mol H2(g)时需要吸收12 kJ的能量
C. 1 mol I2(s)变为1 mol I2(g)时需要吸收17 kJ的能量
D. I2(g)与H2(g)生成HI(g)气体的反应是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. SiO2硬度大的原因与Si、O原子之间的成键方式及排列方式有关
B. 乙醇沸点高于二甲醚的原因与分子间作用力大小有关
C. 冰醋酸溶于水时只破坏分子间作用力
D. MgO熔点高达![]() 是因为其中的离子键较难被破坏
是因为其中的离子键较难被破坏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常状况下,CO是一种无色、无味、有毒的气体,难溶于水,与酸、碱、盐溶液均不反应。已知乙二酸晶体加热分解的方程式为:H2C2O4·2H2O![]() 3H2O+CO2↑+CO↑,不考虑其他因素干扰,如何利用下列装置验证反应产物中含有CO2和CO(装置不能重复使用)。酒精喷灯可作高温热源。请回答下列问题:
3H2O+CO2↑+CO↑,不考虑其他因素干扰,如何利用下列装置验证反应产物中含有CO2和CO(装置不能重复使用)。酒精喷灯可作高温热源。请回答下列问题:
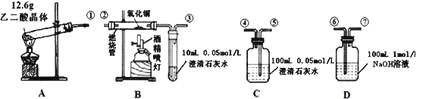
(1)检验装置A气密性的方法是
(2)按气流方向连接各仪器,用数字表示接口的连接顺序:
①→
(3)证明CO存在的实验现象是
(4)本实验尾气处理的方法是
(5)根据题给的数据,假设各反应均充分发生且产生的气体全部排出,并与吸收液充分反应(提示:B、C中澄清石灰水均先变浑浊,后又变澄清),D中溶质及对应的物质的量是: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究铁质材料与热浓硫酸的反应,某学习小组用碳素钢(即铁和碳的合金)进行了以下探究活动:
(探究一)(1)常温下,工业上用铁质容器盛放冷的浓硫酸,其原因是__________。
(2)称取碳素钢6.0g放入15.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到混合气体Y。
①甲同学认为X中除Fe3+之外还可能含有Fe2+。若要确认其中的Fe2+,应选用__________(选填序号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水 d.酸性KMnO4溶液
②乙同学取560mL(标准状况)气体Y通入足量溴水中,然后加入足量BaCl2溶液,经适当操作后得干燥固体4.66g,由此可求算气体Y中SO2的体积分数__________。
(探究二)
根据上述实验中SO2体积分数的分析,丙同学认为气体Y中还可能含有Q1和Q2两种气体,其中Q1气体,在标准状况下,密度为0.0893gL-1。为此设计了下列探究实验装置(图中夹持仪器省略,假设有关气体完全反应)。

(3)装置B中试剂的作用是__________。
(4)分析Y气体中的Q2气体是如何生成的__________。(用化学方程式表示)。
(5)为确认Q2的存在,需在装置中添加洗气瓶M于__________(选填序号)。
a.A之前 b.A﹣B间 c.B﹣C间 d.C﹣D间
(6)如果气体Y中含有Q1,预计实验现象应是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得达到平衡时的有关数据如下[已知X(g)+3Y(g)![]() 2Z(g) ΔH=Q kJ·mol1]:
2Z(g) ΔH=Q kJ·mol1]:
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1 mol X、3 mol Y | 2 mol Z | 4 mol Z |
Z的浓度(mol·L1) | c1 | c2 | c3 |
反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
体系压强(Pa) | p1 | p2 | p3 |
反应物转化率 | α1 | α2 | α3 |
下列说法正确的是
A. 2c1>c3B. a+b=QC. 2p2<p3D. α1+α3>1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯氧磷(POCl3)是一种工业化工原料,可用于制取有机磷农药、长效磺胺药物等,还可用作染料中间体、有机合成的氯化剂和催化剂、阻燃剂等。利用O2和PCl3为原料可制备三氯氧磷,其制备装置如图所示(夹持装置略去):
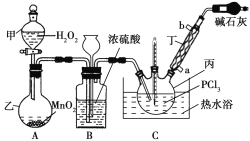
已知PCl3和三氯氧磷的性质如表:
熔点/℃ | 沸点/℃ | 其他物理或化学性质 | |
PCl3 | -112.0 | 76.0 | PCl3和POCl3互溶,均为无色液体,遇水均剧烈水解,发生复分解反应生成磷的含氧酸和HCl |
POCl3 | 1.25 | 106.0 |
(1)装置A中的分液漏斗能否用长颈漏斗代替?做出判断并分析原因:_______
(2)装置B的作用是______________(填标号)。
a.气体除杂 b.加注浓硫酸 c.观察气体流出速度 d.调节气压
(3)仪器丙的名称是___________,实验过程中仪器丁的进水口为__________(填“a”或“b”)口。
(4)写出装置C中发生反应的化学方程式_______,该装置中用温度计控制温度为60~65 ℃,原因是________。
(5)称取16.73 g POCl3样品,配制成100 mL溶液;取10.00 mL溶液于锥形瓶中,加入3.2 mol·L-1的AgNO3溶液10.00 mL,并往锥形瓶中滴入5滴Fe2(SO4)3溶液;用0.20 mol·L-1的KSCN溶液滴定,达到滴定终点时消耗KSCN溶液10.00 mL(已知:Ag++SCN-=AgSCN↓)。则加入Fe2(SO4)3溶液的作用是________,样品中POCl3的纯度为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com