
��1�������绯ѧ��ʦ�����ù����ռ�����500mL 0.20 mol L-1��NaOH��Һ����Ҫ��ȡ____g���壬����ʱ���˽�ͷ�ιܺͲ�����������Ҫ������Ϊ______��
��2��������ʦҪ��36.5% ����=1.18g cm-3����Ũ��������0.4 mol L-1������240 mL����ȷ��ȡ36.5%��Ũ����____mL��
��3��������0.5mol L-1��������Һ��������������ȷ�����������д�����������������Ƶ�������ҺŨ��ƫ�͵���_______������ţ���
A����ϡ�͵�������Һת��������ƿ��δϴ���ձ��Ͳ�������
B����Һʱ����ƿ������������ˮ��
C���ý�ͷ�ι�������ƿ�м�ˮʱ��Һ�����������ƿ�̶ȣ���ʱ�����õιܽ�ƿ��Һ��������ʹ��Һ��Һ����̶����С�
D���ý�ͷ�ιܼ�ˮʱ�����ӹ۲���Һ��Һ��������ƿ�̶����С�
E��ϡ�ͺ�û��ȴ�����¾ͽ���Һת��������ƿ��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�꽭��ʡ�����и�һ��ѧ����ĩ���в��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��������������������������簱������������������·�Ӧ��6NO2��8NH3 7N2��12H2O�����й��ڸ÷�Ӧ˵����ȷ����
7N2��12H2O�����й��ڸ÷�Ӧ˵����ȷ����
A. NH3�������� B. H2O����������
C. NO2����������Ӧ D. ����1 mol H2Oת��2 mol�ĵ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ��ɽ��ʡ�����и�һ��ѧ����ĩ���ԣ�B������ѧ�Ծ��������棩 ���ͣ�ѡ����
һ������������Һ�д���������������ǣ� ��
A. ���д���Mg2+����Һ��Na+��NH4+��SO ����Cl��
����Cl��
B. ������Һ��Na+��Ca2+��SO ����CO
����CO ��
��
C. ���д���Fe3+����Һ��Na+��Mg2+��NO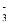 ��SCN��
��SCN��
D. ���д���NO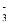 ����Һ��H+��Fe2+��SO
����Һ��H+��Fe2+��SO ����Cl��
����Cl��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017��ӱ�ʡ������ѧ�ڶ����������ۻ�ѧ�Ծ��������棩 ���ͣ�ʵ����
ͭ��һ����Ҫ��ս�����ʣ��Ի�ͭ����Ҫ�ɷ���CuFeS2��Ϊ��Ҫԭ������ͭ�����졢������ʱ��ԭ�ϵ��ۺ������ʽϸߣ�����Ҫ������ͼ��ʾ����֪Na[CuCl2]�ĵ��뷽��ʽΪ��Na[CuCl2]=Na++[CuCl2]-��:
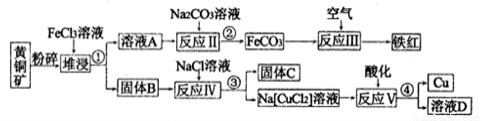
��1�������з����Ŀ����_____________,�����١��ڡ��ۡ��ܵ�Ŀ����ͬ,��ʵ�������ֲ�����������____________��
��2���������Ҫ��;��__________________������B�к������ֲ��һ���ǵ���C����һ����ԭ�Ӹ�����Ϊ1��l ��һ�ֽ����ĵͼ�̬�Σ�д���ѽ�ʱ��Ӧ�Ļ�ѧ����ʽ��________��
��3����ӦV�����ӷ���ʽ��___________________��
��4���˷����еõ���ͭ���Ȳ�������ijЩ��������Ҫ����Ҫ���õ�ⷨ�����ᴿ��������ͼ��ʾ��װ�ý��е�⾫������������Һ��������_________��e�缫�ϵĵ缫��ӦʽΪ_____��

������·����2mol����ͨ��ʱ������ij���缫����������63.92g�����ͭ�Ĵ���Ϊ����������ֻ�����Ҿ���ʱͭ�����ķŵ���������������ͬ������ʱ�ã���ʾ����һλС����____________����֪���ԭ��������Fe 56 Cu 64 ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017��ӱ�ʡ������ѧ�ڶ����������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
��NAΪ�����ӵ�����������˵���������( )
A. ��״����22.4LCl2��H2�ϻ�����ԭ����Ϊ2NA
B. lmolNa2O2��������ˮ��ȫ��Ӧ��ת�Ƶĵ�����ΪNA
C. 1mol���ʯ�к����ۼ���ĿΪ4NA
D. ���ʳ��ˮ������2g��������ת�Ƶĵ�����ĿΪ2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�꽭��ʡ�ϲ��и�һ��ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪�����·�Ӧ���� 2BrO3-+Cl2=Br2+2ClO3-
��ClO3-+5Cl-+6H+=3Cl2+3H2O
��2FeCl2+Cl2=2FeCl3
����������Ӧ���ж����н����д�����ǣ� ��
A. Cl2�ڷ�Ӧ���м��������������ǻ�ԭ����
B. ������ǿ����˳��Ϊ��BrO3-��ClO3-> Cl2>Fe3+
C. ��Һ�пɷ�����ClO3-��6Fe2++6H+=Cl-��6Fe3++3H2O
D. Cl2�ڢ١��۷�Ӧ�о���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�꽭��ʡ�ϲ��и�һ��ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�����ѧ��ʦ�����ʳ�û����Ͳ�С�Ļ����˴�����ˮ����������ѧ��֪ʶ����ʦ����֮������������ķ��뷽����( )
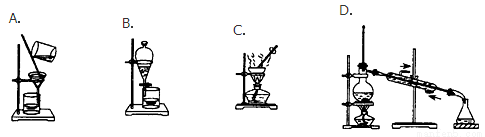
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ���㶫ʡ2016-2017ѧ��߶���ѧ����ĩ���Ի�ѧ���ģ��Ծ� ���ͣ�ѡ����
�����ᴿ�ǻ��������г��õķ���������˵����������
A. ��������ˮ�ɵõ�����ˮ B. ���ܷ���ȥAl2O3��Fe2O3
C. ���˷���ȥ�����е��Ҵ� D. ���ܷ���ȥAl2O3�е�SiO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017���㽭ʡ�����и����ڶ���ѡ��ģ�⿼�ԣ�2�£���ѧ�Ծ��������棩 ���ͣ������
����48.4g��ʽ̼��þ��Ʒ����ѧʽ��xMgCO3��yMg(OH)2��zH2O��x��y��zΪ���������������Ϊ���ȷݣ�һ����Ʒ������������ؽ������ط����������ͼ��ʾ����һ��Ͷ��150mLij��Һ�������У���ַ�Ӧ������CO24.48L����֪��ɱ�״���£���������Һϡ����250mL�������Һ��c(H+)=0.100mol/L��
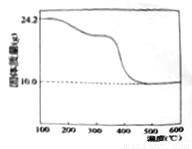
��Ҫ��ش��������⣺
��1����������ʵ���Ũ��c(HCl)=______mol/L
��2��x:y:z=______��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com