
一定温度下,水溶液中H+和OH-的浓度变化曲线如图,下列说法正确的是

A. 升高温度,可能引起由c向b的变化
B. 该温度下,水的离子积常数为1.0×10-13
C. 该温度下,加入FeCl3可能引起由b向a的变化
D. 该温度下,稀释溶液可能引起由c向d的变化
科目:高中化学 来源:2017届湖南省衡阳市高三第二次质检化学试卷(解析版) 题型:选择题
设NA表示阿伏加德罗常数的值。下列叙述正确的是
A. 1.00mol NaCl中含有NA个NaCl 分子
B. 常温常压下,22.4LCl2与足量镁粉反应,转移的电子数为2NA
C. 一定条件下,2.3gNa与足量O2完全反应生成3.6g产物时失去的电子数为0.1NA
D. 28g乙烯和环丙烷(C3H6)组成的混合气体中含有氢原子的个数为3 NA
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省湛江市高二上学期期末调研考试化学试卷(解析版) 题型:实验题
某食用白醋是由醋酸与纯水配制而成,用中和滴定的方法准确测定其中醋酸的物质的量浓度。实验步骤:①配制500mL浓度约为0.1 mol·L-1的NaOH溶液;②用KHC8H4O4标准溶液准确测定该NaOH溶液的浓度;③用已知准确浓度的NaOH溶液测定醋酸的浓度。
(1)称量所需的NaOH固体置于大烧杯中,加入500mL蒸馏水,搅拌溶解。该配制步骤 (填“可行”或“不可行”)。
(2)称量时NaOH在空气中极易吸水,配制所得的NaOH溶液浓度通常比预期 (填“小”或“大”),这是不能直接配制其标准溶液的原因。
(3)查阅白醋包装说明,醋酸含量约为6g/100mL,换算成物质的量浓度约为 mol·L-1,滴定前将白醋稀释 (填“10”或“100”)倍。(已知醋酸的相对分子质量为60)
(4)稀释白醋时需要的仪器有烧杯、玻璃棒、滴管、酸式滴定管、 。
(5)准确量取稀释后的白醋20.00mL,置于250mL锥形瓶中,加水30mL,再滴加酚酞指示剂,用上述NaOH标准溶液滴定至 即为终点。重复滴定两次,平均消耗NaOH标准溶液V mL(NaOH溶液浓度为c mol·L-1)。
(6)原白醋中醋酸的物质的量浓度= mol·L-1。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省湛江市高二上学期期末调研考试化学试卷(解析版) 题型:选择题
下列各组离子能大量共存且溶液颜色为无色的是
A. Na+、MnO4-、K+、NO3-、SO32- B. Na+、S2-、SO32-、H+、、NO3-
C. Na+、S2-、OH-、K+、Cl- D. HCO3-、H+、Na+、Ca2+、SO32-
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省漳州市高二上学期期末考试化学试卷(解析版) 题型:简答题
(1)NaBH4与水反应生成NaBO2和氢气,在25 ℃、101 kPa下,已知每消耗3.8 g NaBH4放热21.6 kJ,该反应的热化学方程式是________________。
(2)相同温度下,等物质的量浓度的下列溶液:①(NH4)2SO4 ②(NH4)2CO3 ③(NH4)2Fe(SO4)2 ④NH4HSO4 ⑤NH4Cl ⑥NH3·H2O, c(NH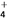 )大小顺序为________________。
)大小顺序为________________。
(3)在一定温度下的定容容器中,当下列物理量不再发生变化时:①混合气体的压强,②混合气体的密度,③混合气体的总物质的量,④混合气体的平均相对分子质量,⑤某种气体的百分含量
a.能说明2SO2(g)+O2(g) 2SO3(g)达到平衡状态的是________。
2SO3(g)达到平衡状态的是________。
b.能说明A(s)+2B(g) C(g)+D(g)达到平衡状态的是________。
C(g)+D(g)达到平衡状态的是________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省漳州市高二上学期期末考试化学试卷(解析版) 题型:选择题
在恒容密闭容器中,用铜铬的氧化物作催化剂,用一定量的HCl(g)和O2制取Cl2的原理为:4HCl(g)+O2(g)  2Cl2(g)+2H2O(g) ΔH<0。下列有关说法不正确的是
2Cl2(g)+2H2O(g) ΔH<0。下列有关说法不正确的是
A. 平衡前,随着反应的进行,容器内压强变小
B. 平衡时,其他条件不变,分离出H2O(g),逆反应速率减小
C. 平衡时,其他条件不变,升高温度平衡常数增大
D. 其他条件不变,使用不同催化剂,HCl(g)的转化率不变
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省漳州市高二上学期期末考试化学试卷(解析版) 题型:选择题
H2S(g)+ O2(g)===SO2(g)+H2O(g)ΔH1
O2(g)===SO2(g)+H2O(g)ΔH1
2H2S(g)+SO2(g)=== S2(g)+2H2O(g)ΔH2
S2(g)+2H2O(g)ΔH2
H2S(g)+ O2(g)===S(g)+H2O(g)ΔH3 2S(g)===S2(g)ΔH4
O2(g)===S(g)+H2O(g)ΔH3 2S(g)===S2(g)ΔH4
则ΔH4的正确表达式为
A. ΔH4= (ΔH1+ΔH2-3ΔH3) B. ΔH4=
(ΔH1+ΔH2-3ΔH3) B. ΔH4= (3ΔH3-ΔH1-ΔH2)
(3ΔH3-ΔH1-ΔH2)
C. ΔH4= (ΔH1+ΔH2-3ΔH3) D. ΔH4=
(ΔH1+ΔH2-3ΔH3) D. ΔH4= (ΔH1-ΔH2-3ΔH3)
(ΔH1-ΔH2-3ΔH3)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省张家口市高二上学期期末考试化学试卷(解析版) 题型:选择题
在一体积可变的密闭容器中,加入一定量的X、Y、Z,发生反应mX(g)+nY(g)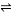 pZ(g)ΔH=QkJ·mol-1。反应达到平衡后,Y的物质的量浓度与温度、容器体积的关系如下表所示。
pZ(g)ΔH=QkJ·mol-1。反应达到平衡后,Y的物质的量浓度与温度、容器体积的关系如下表所示。
容器体积/L c(Y)/(mol·L-1) 温度/℃ | 1 | 2 | 3 |
100 | 1.00 | 0.75 | 0.53 |
200 | 1.20 | 0.90 | 0.63 |
300 | 1.30 | 1.00 | 0.70 |
下列说法不正确的是
A. m+n>p
B. Q<0
C. 体积不变,温度升高,平衡向逆反应方向移动
D. 温度不变,压强增大,Y的质量分数增大
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省大连市高二上学期期末考试(文)化学试卷(解析版) 题型:实验题
学习与研究化学经常要进行实验,请完成以下课题:
(1)玻璃棒的作用主要有以下三种,请回答下列问题:
a.搅拌 b.引流 c.蘸取溶液
① 实验室配制一定物质的量浓度溶液,将固体溶解时,玻璃棒的作用是____(填字母),
② 将烧杯中的溶液注入容量瓶时,玻璃棒的作用是_____(填字母),
③ 用浓盐酸检验氨气时,玻璃棒的作用是_____(填字母),
④ 粗盐提纯时,用过滤的方法除去不溶性的泥沙,玻璃棒的作用是_____(填字母)。
(2)现用98%的浓H2SO4( =1.84 g/cm3)配制浓度为0.5 mol/L的稀硫酸500 mL。
=1.84 g/cm3)配制浓度为0.5 mol/L的稀硫酸500 mL。
①选用的玻璃仪器除了量筒、玻璃棒、烧杯,还用到________、________。
②将浓H2SO4沿烧杯内壁慢慢注入盛水的烧杯中,不断搅拌的目的是______________,若搅拌过程中有液体溅出,会使最终结果_______(填“偏高”、“偏低”或“无影响”)。
③定容时必须使溶液凹液面与刻度线相切,若俯视会使结果_______(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com