
用NA表示阿伏加德罗常数的值,下列说法中正确的是
A. 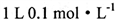 的NH4NO3溶液中氮原子数小于0.2NA
的NH4NO3溶液中氮原子数小于0.2NA
B. 某温度时,1LpH=6的纯水中含有1.0X10-6NA个OH-
C. 在O2参加的反应中,1mol O2作氧化剂时得到的电子数一定是4NA
D. 向含有0.4 mol FeBr2的溶液中通入0.3 mol Cl2,充 分反应时转移的电子数为1.2NA
分反应时转移的电子数为1.2NA
科目:高中化学 来源:2016-2017学年江西省南昌市、洪都中学、麻丘中学、十七中、桑海中学高二3月联考化学试卷(解析版) 题型:选择题
下列关于同分异构体数目的叙述不正确的是( )
A.甲苯苯环上的1个氢原子被含3个碳原子的烷基取代,所得产物有6种
B.已知丙烷的二氯代物有4种异构体,则其六氯代物的异构体数目也为4种
C.含有5个碳原子的某饱和链烃,其一氯代物有3种
D.菲的结构为 ,它与硝酸反应,可生成5种一硝基取代物
,它与硝酸反应,可生成5种一硝基取代物
查看答案和解析>>
科目:高中化学 来源:2017届安徽省安庆市高三第二次模拟考试理科综合化学试卷(解析版) 题型:简答题
工业燃烧煤、石油等化石燃料释放出大量NOx、CO、CO2等气体,严重污染空气,对废气进行脱硝,脱碳等处理可实现绿色环保、废物利用。
Ⅰ、脱硝:
已知:①H2的热值为142.9kJ/g(热值是表示单位质量的燃料完全燃烧生成稳定的化合物时所放出的热量);
②N2(g)+2O2(g)=2NO2(g) ΔH=+133kJ/mol
③H2O(g)=H2O(l) ΔH=-44kJ/mol
催化剂存在下,H2还原NO2生成水蒸气和其他无毒物质的热化学方程式为:_______
Ⅱ、脱碳
(1)CO与空气可设计成燃料电池(以熔融的碳酸盐为电解质)。写出该电池的负极反应式:_______。
(2)甲醇是一种可再生能源,工业上可用合成气制备甲醇,反应为CO(g)+2H2(g)  CH3OH(g)。某温度下在容积为VL的密闭容器中进行反应,其相关数据戔右图;反应开始至平衡时,用H2表示化学反应速率为________。该温度下CO的平衡转化率为_________。
CH3OH(g)。某温度下在容积为VL的密闭容器中进行反应,其相关数据戔右图;反应开始至平衡时,用H2表示化学反应速率为________。该温度下CO的平衡转化率为_________。

(3)向1L密闭容器中加入1molCO2、3molH2,在适当的条件下,发生反应CO2(g)+3H2(g)  CH3OH(g)+H2O(g).
CH3OH(g)+H2O(g).
①下列叙述能说明此反应达到平衡状态的是___________。
a.混合气体的平均相对分子质量保持不变
b.CO2和H2的体积分数保持不变
c.CO2和H2的转化率相等
d.混合气体的密度保持不变
e.1molCO2生成的同时又3molH-H键断裂
②相同条件下,在容积都为1L且固定的两个密闭容器中,按如下方式加入反应物,一段时间后反应达到平衡。
容器 | 甲 | 乙 |
反应物投入量 | 1mol CO2、3molH2 | amol CO2、3amolH2 bmolCH3OH(g)、bmolH2O(g) |
若甲中平衡后气体的压强为开始的0.6倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆向反应方向进行,则b的取值可能为_________(填序号)
a.0.7 b.0.9 c.1.2
若保持温度不变,起始加入0.5molCO2、0.5molH2、0.5molCH3OH(g)、0.5molH2O(g) 则此反应速率的关系:v正__________v逆。(填“>”、“<”或“=”)
查看答案和解析>>
科目:高中化学 来源:2017届内蒙古赤峰市宁城县高三一模理科综合化学试卷(解析版) 题型:选择题
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为: 下列叙述错误的是
下列叙述错误的是
A. 放电时正极附近溶液的碱性增强
B. 充电时锌极与外电源正极相连
C. 放电时每转移3 mol电子,正极有1mol K2FeO4被还原
D. 充电时阳极反应为:Fe(OH)3 - 3e- + 5OH- FeO42- + 4 H2O
查看答案和解析>>
科目:高中化学 来源:2016届湖南省高三2月模拟理科综合化学试卷(解析版) 题型:简答题
五种短周期元素A、B、D、E、G的原子序数依次增大,其中A、G同主族, B、D、E同周期。A分别与B、E、G形成原子个数比为1:1的化合物甲、乙、丙,它们在 常温常压下分别为气体、液体、固体,甲燃烧时火焰明亮且产生浓烈的黑烟,丙为离子晶体。
(1)D的基态原子有______个未成对电子,甲的电子式为____________
(2)丙与水剧烈反应生成强碱X和A的单质,其化学方程式为______。
(3)乙的水溶液显弱酸性,它在水中的电离方程式为______。
(4)B、E两种元素按原子个数比1:2形成化合物Y,当X与Y按物质的量之比为2:1 完全反应后,所得溶液浓度为0.1 mol/L,其中各离子浓度从大到小的顺序排列为______。
(5)在25°C、10lkPa时,16.0g液态D2A4在氧气中完全燃烧放出热量312 kJ,生成两 种无污染物质,其中一种为单质,另一种是氧化物。写出该反应的热化学方程式______。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二2月联考化学试卷(解析版) 题型:简答题
在100℃时,将0.40 mol二氧化氮气体充入一个1 L抽空的密闭容器中,发生反应:2NO2 N2O4。每隔一段时间就对该容器内的物质进行分析,得到下表数据:
N2O4。每隔一段时间就对该容器内的物质进行分析,得到下表数据:
时间/s | 0 | 20 | 40 | 60 | 80 |
n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
(1)在上述条件下,从反应开始至20 s时,用NO2表示的平均反应速率为_____________。
(2)该反应的平衡常数K的数值为___________(精确到0.1)。
(3)若在相同条件下最初向该容器中充入N2O4,要达到上述平衡状态,N2O4的起始浓度是______mol·L?1。
(4)上述(3)达到平衡后N2O4的转化率为_______,混合气体的平均摩尔质量为____________。
(5)达到平衡后,如果升高温度,气体颜色会变深,则升高温度后,反应2NO2 N2O4的平衡常数将________(填“增大”“减小”或“不变”)。
N2O4的平衡常数将________(填“增大”“减小”或“不变”)。
(6)达到平衡后,如果向该密闭容器中再充入0.32 mol He,并把容器体积扩大为4 L,则平衡将_____(填“向左移动”“向右移动”或“不移动”)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二2月联考化学试卷(解析版) 题型:选择题
下列有关实验操作的解释或结论正确的是
选项 | 实验操作 | 解释或结论 |
A | 将FeCl3溶液加入Mg(OH)2悬浊液中,振荡,可观察到沉淀由白色变为红褐色 | Fe(OH)3的溶解度小于Mg(OH)2的 |
B | 用蒸馏水润湿的pH试纸测溶液的pH | 一定会使测定结果偏低 |
C | 测定中和热时,使用碎泡沫起隔热保温的作用,用普通玻璃棒进行搅拌使酸和碱充分反应,准确读取实验时的最高温度并且取2~3次的实验平均值等,以达到良好的实验效果 | 用简易量热计 测定反应热来 |
D | 用氢氧化钾与浓硫酸测定中和反应的反应热 | 测得的结果偏小 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省枣庄市南校区高一3月月考化学试卷(解析版) 题型:选择题
甲、乙是周期表中同一主族的两种元素,若甲的原子序数为x,则乙的原子序数不可能是
A. x+2 B. x+4 C. x+34 D. x+26
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高一下学期第一次月考化学试卷(解析版) 题型:选择题
实际存在的 H、
H、 H、
H、 H、H和H-,它们是
H、H和H-,它们是
A. 氢的五种同位素 B. 五种氢元素
C. 氢元素的五种不同微粒 D. 氢的五种同素异形体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com