
【题目】聚乳酸的结构简式如图 a,下列叙述错误的是
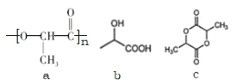
A.b 是合成聚乳酸的单体
B.1mol 乳酸与足量钠反应,生成 2mol 氢气
C.n mol 乳酸缩聚生成图 a 结构,同时生成 n molH2O
D.c 属于环酯,1molc 水解消耗 2molNaOH
科目:高中化学 来源: 题型:
【题目】为验证Cl2、Fe3+、I2三者氧化性的相对强弱,某小组用如图所示装置进行实验(夹持仪器已略去,气密性已检验)。
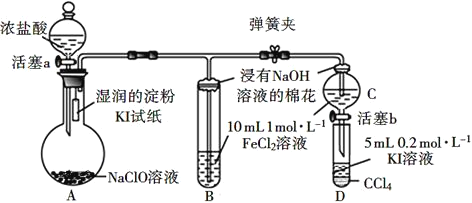
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.向B中加入一定量KSCN溶液,混合液显红色,一段时间后,B中溶液红色加深,关闭活塞a。
Ⅳ.……
(1)A中产生黄绿色气体,写出A中发生反应的化学反应方程式:___。
(2)验证氯气的氧化性强于碘单质的实验现象是___。
(3)B中溶液发生反应的离子方程式是___。
(4)为验证Fe3+的氧化性强于碘单质,过程Ⅳ的操作和现象是___,对应反应的离子方程式是___。
(5)浸有氢氧化钠溶液的棉花作用是__。
(6)过程Ⅲ实验的目的是__。
(7)若将氯气通入无色碘化钾溶液中,无色溶液先变为黄色,继续通入氯气后,溶液又变为无色,已知每1molKI完全反应转移6mol电子,写出过量氯气与碘化钾溶液反应的离子方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种三电极电解水制氢的装置如图,三电极为催化电极a、催化电极b和Ni(OH)2电极。通过控制开关连接K1或K2,可交替得到H2和O2。下列说法错误的是( )
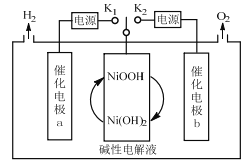
A.制O2时,电子由Ni(OH)2电极通过外电路流向催化电极b
B.制H2时,阳极的电极反应式为Ni(OH)2+OH--e-=NiOOH+H2O
C.催化电极b上,OH-发生氧化反应生成O2
D.该装置可在无隔膜的条件下制备高纯氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现将足量的AgCl分别放入下列物质中,AgCl的溶解度由大到小的顺序是
①20mL 0.01mol·L-1 KCl溶液 ②30mL 0.02mol·L-1 CaCl2溶液③40mL 0.03mol·L-1 HCl溶液
A.①>③>②B.①>②>③C.②>①>③D.③>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知短周期元素的离子:aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是( )
A. 原子半径:A>B>D>CB. 原子序数:d>c>b>a
C. 离子半径:C>D>B>AD. 单质的还原性:A>B>D>C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度25℃时,用Na2S沉淀Cu2+、Zn2+两种金属离子(M2+),所需S2-最低浓度的对数值lg c(S2-)与lg c(M2+)关系如图所示。下列说法不正确的是
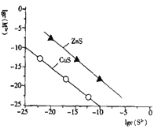
A.25℃时,Ksp(CuS)约为l×10-35
B.向Cu2+浓度为10-5mol/L废水中加入ZnS粉末,会有CuS沉淀析出
C.向l00mL浓度均为10-5mol/L Zn2+、Cu2+的混合溶液中逐滴加入10-4mol/L的Na2S溶液,Cu2+先沉淀
D.Na2S溶液中:c(S2-)+c(HS-)+c(H2S)=2c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某饱和氯化钠溶液的体积为V mL,溶液的密度为d g/cm3,溶质的质量分数为w,物质的量浓度为c mol/L,溶液中含NaCl的质量为m g。
(1)用w表示该温度下NaCl的溶解度为________。
(2)用m、V表示溶液的物质的量浓度为________。
(3)用w、d表示溶液的物质的量浓度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向二元弱酸H2Y溶液中滴加 KOH 溶液,所得混合溶液的 pH 与 P[P=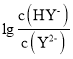 或
或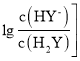 变化关系如图所示。下列说法正确的是
变化关系如图所示。下列说法正确的是
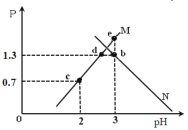
A.曲线 M 表示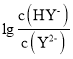 随 pH 的变化关系
随 pH 的变化关系
B.Ka2 的数值是10-6
C.e 点溶液中:2c(Y2-)+c(HY-)﹣c(K+)+c(OH-)=0.001mol·L-1
D.KHY 溶液中:c(K+)>c(HY﹣)>c(H+)>c(Y2-)>c(H2Y)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲酸是基本有机化工原料之一,广泛用于农药、皮革、染料、医药和橡胶等工业。
(1)工业上利用甲酸的能量关系转换图如图:

反应![]() 的焓变
的焓变![]() ________
________![]() 。
。
(2)某科学小组研究不同压强条件对反应![]() 的影响。
的影响。![]() 下,在一个容积可变的密闭容器中,充入一定量的
下,在一个容积可变的密闭容器中,充入一定量的![]() 和
和![]() ,测得不同压强下,平衡时容器内气体的浓度如下表:
,测得不同压强下,平衡时容器内气体的浓度如下表:
试验编号 | 反应压强 | 物质浓度 | ||
|
|
| ||
1 |
| 0.3 | 0.3 | 0.9 |
2 |
|
|
| 0.4 |
3 |
| 0.4 | 0.4 |
|
试回答以下问题:
①平衡时,实验1的正反应速率________(填“>”、“<”或“=”)实验3的逆反应速率。
②由实验1的数据可计算![]() 时,该反应的平衡常数
时,该反应的平衡常数![]() ________。
________。
③![]() ________
________![]() 。
。
(3)经研究发现采用电还原法也可将![]() 转化为甲酸根,同时还能提高
转化为甲酸根,同时还能提高![]() 的转换效率。其电解原理如图所示,下列叙述正确的是________。
的转换效率。其电解原理如图所示,下列叙述正确的是________。
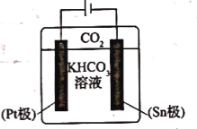
A.![]() 极的电极反应式为
极的电极反应式为![]()
B.电解过程中![]() 向
向![]() 极移动
极移动
C.![]() 极发生还原反应并有气体逸出
极发生还原反应并有气体逸出
D.电解过程中![]() 浓度逐渐减小
浓度逐渐减小
(4)甲酸的用途之一是用于配制“缓冲溶液”,在这种溶液中加入少量的强酸蚀碱,溶液的![]() 变化不大,能保持溶液
变化不大,能保持溶液![]() 相对稳定。(已知甲酸的电离平衡常数
相对稳定。(已知甲酸的电离平衡常数![]() )
)
①现将等浓度甲酸与甲酸钠溶液混合,配成![]() 的
的![]() 缓冲溶液。用离子方程式表示将少量强碱加入
缓冲溶液。用离子方程式表示将少量强碱加入![]() 缓冲溶液中,
缓冲溶液中,![]() 变化不大的原因是________。
变化不大的原因是________。
②若用![]() 溶液配制
溶液配制![]() 为4的缓冲溶液,需加入________
为4的缓冲溶液,需加入________![]() (答案保留一位小数)
(答案保留一位小数)![]() 溶液。
溶液。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com