
| A. | 单质的密度依次增大 | B. | 单质的熔点和沸点依次升高 | ||
| C. | Cl2可以从KI溶液中置换出I2 | D. | Br2可以从NaCl溶液中置换出Cl2 |
分析 A.卤素单质的密度随着原子序数增大而增大;
B.卤素单质的熔沸点随着原子序数增大而增大;
C.元素的非金属性越强,其单质的氧化性越强,氧化性较强的单质能置换出氧化性较弱的单质;
D.元素的非金属性越强,其单质的氧化性越强,氧化性较强的单质能置换出氧化性较弱的单质.
解答 解:A.从氟到碘,它们的单质都是分子晶体,其状态从气体到固态,分子之间距离逐渐减小,其单质密度从氟到碘依次增大,故A正确;
B.从氟到碘,它们的单质都是分子晶体,分子晶体的熔沸点与其相对分子质量成正比,所以其单质的熔沸点随着原子序数增大而增大,故B正确;
C.元素的非金属性越强,其单质的氧化性越强,氧化性较强的单质能置换出氧化性较弱的单质,非金属性Cl>I,所以Cl2可以从KI溶液中置换出I2,故C正确;
D..元素的非金属性越强,其单质的氧化性越强,氧化性较强的单质能置换出氧化性较弱的单质,非金属性Cl>Br,所以Br2不能从NaCl溶液中置换出Cl2,故D错误;
故选D.
点评 本题以卤族元素为载体考查同一主族元素性质递变规律,熟练掌握碱金属族、卤族、第三周期元素结构及其性质递变规律,题目难度不大.


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:解答题
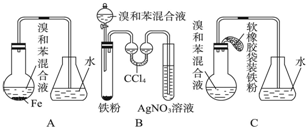
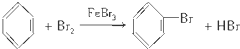 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若把H2S写成H3S,则违背了共价键的饱和性 | |
| B. | H3O+的存在说明共价键不应有饱和性 | |
| C. | 所有共价键都有方向性 | |
| D. | 两原子轨道发生重叠后,电子在两核间出现的概率减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
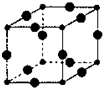 Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的巨大作用.
Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的巨大作用.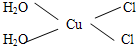 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为红色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | 氯气与水反应生成的HClO将石蕊氧化为无色物质 |
| 然后溶液从无色逐渐变为浅黄绿色色 | 继续通入的氯气溶于水使溶液呈浅黄绿色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com