
下列溶液中Cl-浓度最大的是
A.10ml 0.2mol/L的FeCl3溶液
B.10ml 0.1mol/L的AlCl3溶液
C.20ml 0.1mol/L的MgCl2溶液
D.20ml 0.1mol/L的HCl溶液
 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源:2016届江苏省高三上第二次阶段测化学试卷(解析版) 题型:选择题
21世纪化学的最新定义为“化学是一门创造新物质的科学”。下列有关说法不正确的是
A.用CO2合成可降解的聚碳酸酯塑料,可以实现“碳”的循环利用
B.开发利用太阳能、生物质能等清洁能源,有利于节约资源
C.绿色化学的核心是应用化学原理对环境污染进行治理
D.制备物质时探究反应中高的选择性、转化率和原子利用率,属于“绿色”的生产工艺
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽省高二上学期第三次月考化学试卷(解析版) 题型:填空题
高炉炼铁过程中发生的主要反应为:
 Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)
 Fe(s)+CO2(g)
Fe(s)+CO2(g)
已知该反应在不同温度下的平衡常数如下表:请回答下列问题:
温度/℃ | 1000 | 1150 | 1300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
(1)该反应的平衡常数表达式K=________,ΔH________0 ( 填“>”.“<”或“=” );
(2)在体积为10 L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过10 min后达到平衡。该时间范围内反应的平均反应速率v(CO2)= ,CO的平衡转化率为 。
(3)欲提高(2)中CO的平衡转化率,可采取的措施是________。
A 减少Fe的量 B 增加Fe2O3的量 C 移出部分CO2
D 提高反应温度 E 减小容器的容积 F 加入合适的催化剂
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高二上期末化学试卷(解析版) 题型:填空题
50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(1)从实验装置看,图中尚缺少的一种玻璃仪器是_______________。
(2)烧杯间填满碎纸条的作用是_________________________。
(3)实验中改用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比较,所放出的热量__________(填“相等”或“不相等”),中和热__________(填“相等”或“不相等”),理由是______________________________。
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得中和热的数值与57.3kJ/mol相比较会____________。(填“偏大”、“偏小”或“无影响”)。
(5)完整地做一次这样的实验,需测定_________次温度。
(6)大烧杯上如不盖硬纸板,求得的中和热数值_________(填“偏大”、“偏小”或“无影响”
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高一上期末化学试卷(解析版) 题型:选择题
FeCl3、CuCl2的混合溶液中加入铁粉,充分反应后仍有固体存在,则下列判断不正确的是
A.加入KSCN溶液一定不变红色
B.溶液中一定含Fe2+
C.溶液中一定不含Cu2+
D.剩余固体中一定含Cu
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南师大附属中学高二上二次阶段测化学卷(解析版) 题型:选择题
下列关于电解质溶液的叙述正确的是
A.室温下,将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+)
B.室温下,pH=3的氢氟酸加水稀释后,溶液pH减小
C.室温下,pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
D.向0.1mol/L的氨水中加入少量硫酸铵固体,则溶液中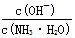 增大
增大
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南师大附属中学高一上三次阶段测化学卷(解析版) 题型:选择题
化学与生产、生活密切相关。下列叙述中正确的是
A.用浓H2SO4刻蚀工艺玻璃上的纹饰
B.高纯度的硅单质广泛用于制作光导纤维
C.漂白粉和明矾都常用于自来水的处理,二者的作用原理是相同的
D.制饭勺、饭盒、高压锅等的不锈钢是合金
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古巴彦淖尔一中高一上期中化学试卷(解析版) 题型:选择题
如图是某溶液在稀释过程中溶质的物质的量浓度随溶液体积的变化曲线图,根据图中数据分析可得出a值
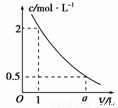
A.2 B.3 C.4 D.5
查看答案和解析>>
科目:高中化学 来源:2016届贵州省高三上学期1月月考理综化学试卷(解析版) 题型:填空题
硫及其化合物有广泛应用。
(1)硫酸生产过程中涉及以下反应。已知25℃、l0l kPa时:
①2SO2(g)+O2(g)+2H2O(l)=2H2SO4(l) ΔH=-457kJ/mol
②SO3(g) +H2O(l)=H2SO4(l) ΔH=-130kJ/mol
则SO2催化氧化为SO3(g)的热化学方程式为__________________。
(2)对于SO3催化氧化为SO3的反应。
①甲图是SO2(g)和SO3(g)的浓度随时间的变化情况。反应从开始到达到平衡时,用O2表示的平均反应速率为________________。
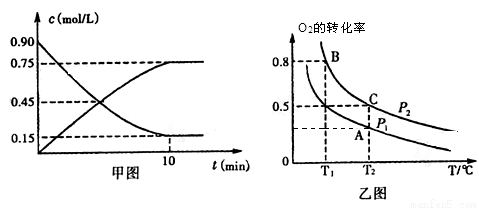
②在一容积可变的密闭容器中充入20mol SO2(g)和l0 mol O2(g),O2的平衡转化率随温度(T)、压强(P)的变化如图乙所示。则P1与P2的大小关系是P1________________ P2(填>、=或<);A、B、C三点的平衡常数大小关系为____________(用KA、KB、KC和 >、=、<表示),理由是______________________。
(3)工业生成硫酸过程中,通常用氨水吸收尾气。①如果在25℃时,相同物质的量的SO2与NH3溶于水,发生反应的离子方程式为__________,所得溶液中c(H+)-c(OH-)=___________(填序号)。
A.c(SO32-)-c(H2SO3)
B.c(HSO3-)+c(SO32-)-c(NH4+)
C.c(SO32-)+c(NH3?H2O)-c(H2SO3)
D.c(HSO3-)+2c(SO32-)-c(NH4+)
②已知在25℃时NH3·H2O、H2SO3电离平衡常数如下表,则上述所得溶液中各离子浓度由大到小的顺序为_____________________。
NH3·H2O | H2SO3 | ||
电离平衡常数(mol/L) | 1.7×10-5 | Ka1 | Ka2 |
1.54×10-2 | 1.02×10-7 | ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com