
| A. | 除去氯化钠溶液中的泥沙--蒸发结晶 | |
| B. | 分离水和乙醇--蒸馏 | |
| C. | 用四氯化碳提取溴水中的溴单质--萃取 | |
| D. | 分离汽油和水--分液 |
科目:高中化学 来源: 题型:解答题

| 温度/ | 0 | 10 | 20 | 30 | 40 |
| S(CaCl2)/g | 59.5 | 64.7 | 74.5 | 100 | 128 |
| S[Ca(ClO3)2]/g | 209 | ||||
| S(KClO3)/g | 3.3 | 5.2 | 7.3 | 10.2 | 13.9 |

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 体系有自发地向混乱度增加(即熵增)的方向转变的倾向,这是自然界的普遍规律 | |
| B. | 判断过程的自发性能确定过程能否发生和过程发生的速率 | |
| C. | 其它条件相同时,增大反应物浓度能使分子获得能量,活化分子百分数提高,反应速率增大 | |
| D. | 催化剂不影响反应活化能,从而只影响反应速率,不影响化学平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题:
氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

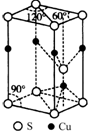
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH均为12的烧碱溶液与Ba(OH)2溶液的物质的量浓度之比 | |
| B. | (NH4)2SO4溶液中c(NH4+)与c(SO42-)之比 | |
| C. | 0.2mol/L的CH3COOH溶液与0.1mol/L和CH3COOH溶液中c(H+)之比 | |
| D. | 0.2mol/L的HCl与0.1mol/LHNO3溶液中n(H+)之比 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 向苦卤中通入Cl2是为了提取溴 | |
| B. | 粗盐可采用除杂和重结晶等过程提纯 | |
| C. | 工业生产中常选用NaOH作为沉淀剂 | |
| D. | 富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其氧化吸收 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag | |
| B. | 碳酸氢钙与过量的NaOH溶液反应:Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- | |
| C. | 用稀硝酸除去试管内壁银:Ag+2H++NO3-═Ag++NO2↑+H2O | |
| D. | 向氨水中通入过量SO2:SO2+2NH3•H2O═2NH4++SO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化氢与氢氧化钠反应的中和热△H=-57.3kJ/mol,则硫酸和氢氧化钡反应的△H=-2×(-57.3)kJ/mol | |
| B. | CO(g)的燃烧热是283.0KJ/mol,则表示一氧化碳的燃烧热的热化学方程式为CO(g)+1/2O2(g)=CO2(g)△H=-283.0kJ/mol | |
| C. | 需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应 | |
| D. | 已知: Ⅰ:对于反应:H2(g)+Cl2(g)=2HCl(g)△H=-a kJ/mol Ⅱ:  且a、b、c均大于零,则断开1摩尔H-Cl键所需的能量为(-a-b-c) kJ/mol 且a、b、c均大于零,则断开1摩尔H-Cl键所需的能量为(-a-b-c) kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com