
已知:2Fe + 3Br2 = 2FeBr3,Fe2+的还原性大于Br-现有16.8g铁和0.3molBr2反应后加入适量水后,通入amolCl2。
①.当a≤0.15时,反应离子方程式为
②.当Fe2+与Br-同时被氧化时,a的取值范围为
③.当a=0.3时,反应后氧化产物与还原产物的物质的量之比为 比
科目:高中化学 来源: 题型:阅读理解
| ||
| a |
| b |
| 1 |
| 4 |
| a |
| b |
| 3 |
| 8 |
| 1 |
| 4 |
| a |
| b |
| 3 |
| 8 |
| a |
| b |
| 9 |
| 32 |
| 9 |
| 32 |
查看答案和解析>>
科目:高中化学 来源:2012届江苏省扬州中学高三下学期质量检测(三)化学试卷(带解析) 题型:填空题
(14分)茶是我国人民喜爱的饮品。某校化学兴趣小组的同学设计以下实验来定性检验茶叶中含有钙、铁、铝三种金属元素。
[查阅部分资料]:草酸铵[(NH4)2C2O4]属于弱电解质;草酸钙(CaC2O4)难溶于水;Ca2+、A13+、Fe3+完全沉淀的pH:Ca(OH)2:pH≥13;A1(OH)3:pH≥5.5;Fe(OH)3:pH≥4.1。
试根据上述过程及信息填空:
(1)步骤②加盐酸的作用是 _________________________________________ ;
(2)写出检验Ca2+的离子方程式 ___________________________;
(3)写出沉淀C所含主要物质的化学式 _____________________________;
(4)写出步骤⑧用A试剂生成红色溶液的离子方程式_____________________________;
(5)步骤⑨的作用是 ;
(6)猜测步骤⑩的目的是 _________________________________ ;
(7)已知:2Fe (s)+ 3/2O2 (g)= Fe2O3(s),△H = — Q1 kJ·mol-1
2Al(s) + 3/2O2 (g)= Al 2O3(s),△H = — Q2 kJ·mol-1
则Q1 ___________Q2(填“>”,“<”或“=”) 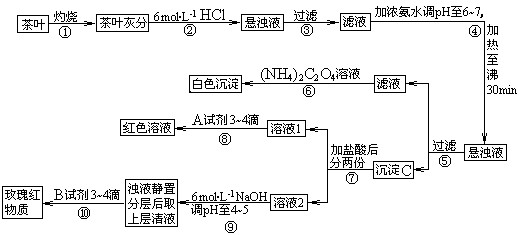
查看答案和解析>>
科目:高中化学 来源:2012-2013学年河南省郑州市高三第三次测验预测理综化学试卷(解析版) 题型:填空题
高铁酸钾(K2Fe04)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂,其生产工艺如下:
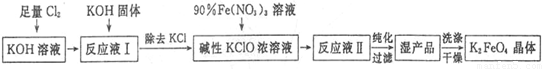
已知:2Fe(NO3)3+3KClO+10KOH=2K2FeO4+6KNO3+3KCl+5H2O
回答下列问题:
(1)将Cl2通入KOH溶液中发生反应的离子方程式是____________。
(2)写出工业上制取Cl2的化学方程式____________。
(3)在“反应液I”中加入KOH固体的目的是____________。
(4)K2FeO4可作为新型多功能水处理剂的原因是____________。
(5)配制KOH溶液时,将61.6 g KOH固体溶解在100 mL水中,所得溶液的密度为 1.47 g • mL-1,则该溶液的物质的量浓度为____________。
(6)从“反应液II”中分离出K2Fe04后,副产品 是___________ (写 化 学 式)。
(7)该工艺每得到1.98kgK2FeO4,理论上消耗Cl2的物质的量为______mol。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江苏省高三下学期质量检测(三)化学试卷(解析版) 题型:填空题
(14分)茶是我国人民喜爱的饮品。某校化学兴趣小组的同学设计以下实验来定性检验茶叶中含有钙、铁、铝三种金属元素。
[查阅部分资料]:草酸铵[(NH4)2C2O4]属于弱电解质;草酸钙(CaC2O4)难溶于水;Ca2+、A13+、Fe3+完全沉淀的pH:Ca(OH)2:pH≥13;A1(OH)3:pH≥5.5;Fe(OH)3:pH≥4.1。
试根据上述过程及信息填空:
(1)步骤②加盐酸的作用是 _________________________________________ ;
(2)写出检验Ca2+的离子方程式 ___________________________;
(3)写出沉淀C所含主要物质的化学式 _____________________________;
(4)写出步骤⑧用A试剂生成红色溶液的离子方程式_____________________________;
(5)步骤⑨的作用是 ;
(6)猜测步骤⑩的目的是 _________________________________ ;
(7)已知:2Fe (s)+ 3/2O2 (g)= Fe2O3(s),△H = — Q1 kJ·mol-1
2Al(s) + 3/2O2 (g)= Al 2O3(s),△H = — Q2 kJ·mol-1
则Q1 ___________Q2 (填“>”, “<”或“=”)

查看答案和解析>>
科目:高中化学 来源:同步题 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com