
����Ŀ��ij������ຬ���ڻ���ͭ(Cu2Te)������������(Cr2O3)�Լ�������ȣ�ijС�����������Դ�ۺ����õķ�����
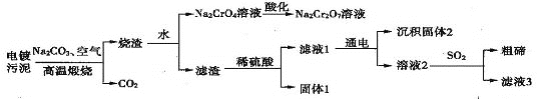
��֪���ں���λ��ͬ���壬����ʱCu2Te�����ķ�ӦΪCu2Te+2O2![]() 2CuO+TeO2��������TeO2����ϡ���ᷢ���ķ�ӦΪTeO2+H2SO4====TeOSO4+H2O��
2CuO+TeO2��������TeO2����ϡ���ᷢ���ķ�ӦΪTeO2+H2SO4====TeOSO4+H2O��
����˵���������
A. �������������������ʱͭ���ں�Ԫ�ض�������
B. ���ữ��ʱ������Һ�м�������
C. ������1������Ҫ�ɷ�ΪCu
D. ����Һ3������ѭ������
���𰸡�C
��������
A.������ຬ���ڻ���ͭ(Cu2Te)������������(Cr2O3),����ʱ������Ӧ�Ļ�ѧ����ʽΪ��3O2+Cr2O3+Na2CO3![]() 4Na2CrO4+4CO2.��Cu2Te+2O2
4Na2CrO4+4CO2.��Cu2Te+2O2![]() 2CuO+TeO2�����ݻ��ϼ۷���ͭ���ں�Ԫ�صĻ��ϼ۶������ˣ����Զ��������ˣ���A��ȷ��B. ���ữ��ʱ�����ķ�Ӧ�����ӷ���ʽΪ��CrO42-+2H+= Cr2O72-+ H2O,���Կ�����Һ�м������ᣬ��B��ȷ��C.�����к���CuO ��TeO2�ͽ𣬼����������Ӧ��CuO+ H2SO4=CuSO4+ H2O ;TeO2+ H2SO4=TeOSO4+H2O��������Ӧ�����Թ���1������Ҫ�ɷ�ΪAu,��C ����D.�ɿ�ͼ֪���Һ�г���TeOSO4��,������CuSO4;SO2��ԭTeOSO4�����������,������Һ3ΪH2SO4�����������п���ѭ�����õ�����������,��D��ȷ���𰸣�C��
2CuO+TeO2�����ݻ��ϼ۷���ͭ���ں�Ԫ�صĻ��ϼ۶������ˣ����Զ��������ˣ���A��ȷ��B. ���ữ��ʱ�����ķ�Ӧ�����ӷ���ʽΪ��CrO42-+2H+= Cr2O72-+ H2O,���Կ�����Һ�м������ᣬ��B��ȷ��C.�����к���CuO ��TeO2�ͽ𣬼����������Ӧ��CuO+ H2SO4=CuSO4+ H2O ;TeO2+ H2SO4=TeOSO4+H2O��������Ӧ�����Թ���1������Ҫ�ɷ�ΪAu,��C ����D.�ɿ�ͼ֪���Һ�г���TeOSO4��,������CuSO4;SO2��ԭTeOSO4�����������,������Һ3ΪH2SO4�����������п���ѭ�����õ�����������,��D��ȷ���𰸣�C��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ƫ��������N2O4�dz��õĻ���ƽ��������߷������»�ѧ��Ӧ��(CH3)2NNH2(l)+2N2O4(l)= 2CO2(g)+3N2(g)+4H2O(g) (��)
(1)��Ӧ(��)����������___________��
(2)����к��г��ֺ���ɫ���壬ԭ��Ϊ��N2O4(g)2NO2(g) (��)���¶�����ʱ��������ɫ�����Ӧ(��)Ϊ______(��������������������)��Ӧ��
(3)һ���¶��£���Ӧ(��)���ʱ�Ϊ��H���ֽ�1mol N2O4����һ��ѹ�ܱ������У�����ʾ��ͼ��ȷ����˵����Ӧ�ﵽƽ��״̬����_________��������ͬ�¶��£�������Ӧ�������Ϊ1L�ĺ����ܱ������н��У�ƽ�ⳣ��______(������������������������С��)��

(4)NO2���ð�ˮ��������NH4NO3 ��25��ʱ����a mol NH4NO3����ˮ����Һ�����ԣ�ԭ����______________(�����ӷ���ʽ��ʾ)�������Һ�μ�b L ��ˮ����Һ�����ԣ���μӰ�ˮ�Ĺ�����ˮ�ĵ���ƽ�⽫________(��������������������������)�ƶ������μӰ�ˮ��Ũ��Ϊ_______molL��1 ��(NH3H2O�ĵ���ƽ�ⳣ��ȡKb=2��10��5molL��1)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������裨SiHCl3�����Ʊ����顢�ྦྷ�����Ҫԭ�ϣ��ڴ��������¿ɷ�����Ӧ��2SiHCl3(g)![]() SiH2Cl2(g)+SiCl4(g)����50 ����70 �� KʱSiHCl3��ת������ʱ��仯�Ľ����ͼ��ʾ��
SiH2Cl2(g)+SiCl4(g)����50 ����70 �� KʱSiHCl3��ת������ʱ��仯�Ľ����ͼ��ʾ��

������������ȷ����
A.�÷�ӦΪ���ȷ�Ӧ
B.��Ӧ���ʴ�С��va ��vb
C.70 ��ʱ��ƽ�ⳣ��K =0.112/0.782
D.����ѹǿ���������SiHCl3��ƽ��ת���ʣ����̴�ƽ���ʱ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.������0.18 mol��L��1��������Һ500 mL���ɲ����������ַ�����
����һ����������ƽ��ȡ________g��ˮ�����ƣ���������ˮ�У����500 mL��Һ������ʱ����������ƿ�̶��ߣ��������ƽ����___________���ƫ��ƫС������Ӱ�족����
���������������Ϊ250 mL��Ũ�Ⱦ�Ϊ________ mol��L��1�Ĵ�����������������Һ��϶���(���Ϻ��������ڻ��ǰ�������֮��)��
��.ijЩ�ǽ������ʿ�����ǿ����Һ������Ӧ���������(P4)�������������NaOH��Һ��Ӧ����PH3�����NaH2PO2(��������)��
(1)д��������Ӧ�Ļ�ѧ����ʽ______________________________
(2) NaH2PO2 Ϊ__________ ������Ρ�����ʽ�Ρ�����
(3)��֪NaH2PO2ˮ��ҺpH>7��������ĵ��뷽��ʽΪ______________________��
NaH2PO2ˮ��ҺpH>7��ԭ��________________________________________��
(4)H3PO2 �� NaH2PO2���ɽ���Һ�е� Ag+ ��ԭΪ�����Ӷ������ڻ�ѧ������
����(H3PO2)���л�ѧ������Ӧ�У��������뻹ԭ�������ʵ���֮��Ϊ 4�U1������������Ϊ��
______________���ѧʽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ������Cl2ͨ��һ��Ũ�ȵĿ��Լ���Һ�У�����ǡ����ȫ��Ӧ(��֪��Ӧ���̷���)���������������ֺ���Ԫ�ص����ӣ�����ClO����ClO3���������ӵ����ʵ���(n)�뷴Ӧʱ��(t)�ı仯ʾ��ͼ��ͼ��ʾ��

����˵����ȷ���� ( )
A.���Լ���Һ��KOH��������4.94g
B.ClO���������������¶����������
C.������ClO����ClO3��
D.��Ӧ��ת�Ƶ��ӵ����ʵ�����0.21mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
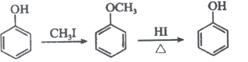
����Ŀ����Ƥ��R( )��Ӧ������Ĥ��������˪�;������С�����һ�ֺϳ�R��·�����£�
)��Ӧ������Ĥ��������˪�;������С�����һ�ֺϳ�R��·�����£�

��֪
��
��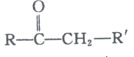 +R����CHO
+R����CHO +H2O
+H2O
(1)A�Ļ�ѧ������___________��B��C�ķ�Ӧ������___________��
(2)D�Ľṹ��ʽ��___________����˴Ź���������___________��塣
(3)E��F�Ļ�ѧ����ʽΪ___________��G�Ĺ����ŵ�������___________��
(4)G��H�Ļ�ѧ����ʽΪ______________________��
(5)M��F��ͬ���칹�壬ͬʱ��������������M�Ľṹ��___________��(�����������칹)
��1����FeCl3��Һ������ɫ��Ӧ ���ܷ���������Ӧ
(6)����Ա�ϩ��1��3������ȩΪ��ʼԭ���Ʊ�![]() �ĺϳ�·��___________(���Լ���ѡ)��
�ĺϳ�·��___________(���Լ���ѡ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������������ȷ����
A. �ڱ�״���£�11.2L O2��22.4L NO��ϲ���ַ�Ӧ��õ�������ķ�����ΪNA
B. ������0.1mol��L��1NH4NO3��Һ�еĵ�ԭ����Ϊ0.2NA
C. 1mol Na������O2��Ӧ������Na2O��Na2O2�Ļ���ת�Ƶĵ�����ΪNA
D. 25��ʱ��1.0L pH��13��Ba(OH)2��Һ�У����е�OH����ĿΪ0.2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£���һ���������ܱ������г���2molA��1molB���������з�Ӧ��2A(g)+B(g)![]() 2C(g) ��H< 0���ﵽƽ�����t1ʱ�̸ı���������ѧ��Ӧ������ʱ��仯��ͼ�����ж�t1ʱ�̸ı��������Ʋ�����ȷ����
2C(g) ��H< 0���ﵽƽ�����t1ʱ�̸ı���������ѧ��Ӧ������ʱ��仯��ͼ�����ж�t1ʱ�̸ı��������Ʋ�����ȷ����

A������ѹǿ���䣬���߷�Ӧ�¶�
B�������¶Ȳ��䣬�����������
C�������¶Ⱥ�����������䣬����1molC(g)
D�������¶Ⱥ�ѹǿ���䣬����1molC(g)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪ���־������ʾ��ͼ��
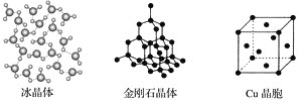
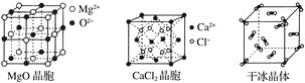
��ش��������⣺
��1�����������У�����֮���Թ��ۼ�����γɵľ�����____��
��2���������ʯ��MgO��CaCl2���ɱ�5�־�����۵��ɸߵ��͵�˳��Ϊ��___��
��3��NaCl������MgO������ͬ��NaCl����ľ�����___(����ڡ���С�ڡ�)MgO���壬ԭ����____��
��4��ÿ��Cu������ʵ��ռ��___��Cuԭ�ӣ�CaCl2������Ca2������λ��Ϊ__��
��5�������۵�Զ���ڸɱ�����H2O�Ǽ��Է��ӡ�CO2�ǷǼ��Է����⣬����һ����Ҫ��ԭ����_____��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com