


科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.铈溶于氢碘酸的化学方程式可表示为:Ce + 4HI = CeI4 + 2H2↑ |
| B.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4+ + Fe2+=Ce3+ + Fe3+ |
| C.在一定条件下,电解熔融状态的CeO2制Ce,在阳极获得铈 |
D.四种铈的核素 Ce、 Ce、 Ce、 Ce、 Ce、 Ce、 Ce,它们互称为同素异形体 Ce,它们互称为同素异形体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 下列说法正确的是
下列说法正确的是| A.Cr2O72-被氧化成CrO5 | B.该反应为氧化还原反应 |
| C.反应中H2O2被还原成H2O | D.此反应用于检验Cr2O72-离子的存在 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O 2 PbCrO4(s)+2H+(aq) ΔH< 0
2 PbCrO4(s)+2H+(aq) ΔH< 0
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NO+NO2+2NaOH==2NaNO3+H2O | B.NH3+HCl== NH4Cl |
| C.Br2+2KI==I2+2KBr | D.2H2O2==2H2O+O2↑ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.浓盐酸在化学反应中既可以做氧化剂,又可以作还原剂 |
| B.工业上常以SiO2为原料制取粗硅,这一过程中,硅元素被氧化 |
| C.在任何条件下都不能发生反应:Cu + H2SO4=CuSO4+ H2↑ |
| D.亚氯酸可发生分解反应:HClO2 → ClO2↑ + Cl2+ H2O(未配平),1 mol HClO2分解时,转移电子的物质的量为1 mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氧化产物只有SO42- |
| B.消耗4molCu2S,参加反应的硝酸为5mol |
| C.若有4mol电子转移,则被氧化的铜有0.4mol |
| D.配平后H2O分子的计量数为1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
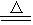 MnCl2+Cl2↑ + 2H2O,
MnCl2+Cl2↑ + 2H2O,查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com