
【题目】下列化学用语对事实的表述不正确的是
A. 硬脂酸与乙醇的酯化反应:C17H35COOH+C2H518OH![]() C17H35COOC2H5+H218O
C17H35COOC2H5+H218O
B. 常温时,0.1 mol·L-1氨水的pH=11.1:NH3·H2O![]()
![]() +OH
+OH
C. 由Na和C1形成离子键的过程:![]()
D. 电解精炼铜的阴极反应:Cu2+ +2e![]() Cu
Cu
【答案】A
【解析】分析:A项,酯化反应的机理是“酸脱羟基醇脱氢”;B项,氨水为弱碱水溶液,存在电离平衡;C项,Na易失电子形成Na+,Cl易得电子形成Cl-;D项,电解精炼铜时,精铜为阴极,粗铜为阳极。
详解:A项,酯化反应的机理是“酸脱羟基醇脱氢”,硬脂酸与乙醇反应的化学方程式为C17H35COOH+C2H518OH![]() C17H35CO18OC2H5+H2O,A项错误;B项,常温下0.1mol·L-1氨水的pH=11.1,溶液中c(OH-)=10-2.9mol·L-1
C17H35CO18OC2H5+H2O,A项错误;B项,常温下0.1mol·L-1氨水的pH=11.1,溶液中c(OH-)=10-2.9mol·L-1![]() 0.1mol·L-1,氨水为弱碱水溶液,电离方程式为NH3·H2O
0.1mol·L-1,氨水为弱碱水溶液,电离方程式为NH3·H2O![]() NH4++OH-,B项正确;C项,Na原子最外层有1个电子,Na易失电子形成Na+,Cl原子最外层有7个电子,Cl易得电子形成Cl-,Na将最外层的1个电子转移给Cl,Na+与Cl-间形成离子键,C项正确;D项,电解精炼铜时,精铜为阴极,粗铜为阳极,阴极电极反应式为Cu2++2e-=Cu,D项正确;答案选A。
NH4++OH-,B项正确;C项,Na原子最外层有1个电子,Na易失电子形成Na+,Cl原子最外层有7个电子,Cl易得电子形成Cl-,Na将最外层的1个电子转移给Cl,Na+与Cl-间形成离子键,C项正确;D项,电解精炼铜时,精铜为阴极,粗铜为阳极,阴极电极反应式为Cu2++2e-=Cu,D项正确;答案选A。


科目:高中化学 来源: 题型:
【题目】(1)FeS2(二硫化亚铁)不溶于水,可溶于适量的稀硝酸中,离子反应式如下:
____ FeS2+ ____ H++ ____ NO3-= ____ Fe2++ ____ S↓+ ____ NO↑+ ____H2O
回答下列问题:配平此氧化还原反应方程式_____________________________________,还原剂为______________。
(2)为了验证Fe3+的性质,某化学兴趣小组设计了如图所示的一组实验,实验方案设计错误的是_____(填字母)

A.④和⑤ B.只有③ C.③和④ D.①②③
(3)已知:氧化性Cl2>Br2>Fe3+,还原性Fe2+>Br->Cl-,则向1L 0.2mol·L-1的FeBr2溶液中通入标准状况下氯气2.24L,被氧化的粒子是________,此反应的离子方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某品牌饮用矿泉水标签的部分内容。下列说法正确的是

A. 标签上离子的浓度是物质的量浓度
B. 由矿泉水制蒸馏水必需使用的玻璃仪器有:圆底烧瓶、酒精灯、温度计、冷凝管、牛角管和锥形瓶
C. 该品牌饮用矿泉水中c(Mg2+)最大值为2×10-4mol/L
D. 一瓶该品牌饮用矿泉水中SO42-的物质的量不超过l×10-5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列化合物:①NaOH,②H2SO4,③CH3COOH,④NaCl,⑤CH3COONa,⑥NH4Cl,⑦CH3COONH4,⑧NH4H2SO4,⑨NH3·H2O,请回答下列问题:
(1)若浓度均为0.1mol·L-1、等体积的NaOH和NH3·H2O分别加水稀释m倍、n倍,
稀释后两种溶液的pH都变成9,则m_______n (填“>”、“<”或“=”)。
(2)已知水存在如下平衡:H2O+H2O![]() H3O++OH-△H>0,现欲使平衡向右移动,且所得溶液显酸性,选择的下列方法是_______。
H3O++OH-△H>0,现欲使平衡向右移动,且所得溶液显酸性,选择的下列方法是_______。
A.向水中加入NaHSO4固体 B.向水中加NaHCO3固体
C.加热至100℃ [其中c (H+) =1×10-6 mol·L-1] D.向水中加入NH4Cl固体
(3)常温下,pH=11的CH3COONa溶液中,水电离出来的c(OH-)=_______;在pH=3的CH3COOH溶液中,水电离出来的c(H+)=_______。
(4)NH4Cl溶液中离子浓度大小顺序为______________。
(5)物质的量浓度相同的⑥、⑦、⑧、⑨四种稀溶液中,NH4+浓度由大到小的顺序是(填序号)_______。
(6)己知t℃时,Kw=1×10-12,在该温度时将pH=9的NaOH溶液a L与pH=2的H2SO4溶液bL混和(忽略混合后溶液体积的变化),若所得混合溶液的pH=3,则出a∶b=_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列说法正确的是( )
A. 常温常压下,11.2L CO2所含的原子数为1.5NA
B. 标准状况下,22.4L H2和N2的混合物中所含原子数为NA
C. 标准状况下,11.2L SO3 中含有2NA个原子
D. 3mol单质Fe完全转变为Fe3O4,失去8NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验的反应原理用离子方程式表示正确的是( )
A. 室温下,测的氯化铵溶液pH<7,证明一水合氨的是弱碱:NH4++2H2O=NH3·H2O+H3O+
B. 用氢氧化钠溶液除去镁粉中的杂质铝:2Al+2OH-+2H2O=2AlO2-+3H2↑
C. 用碳酸氢钠溶液检验水杨酸中的羧基:
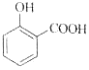 +2HCO3-→
+2HCO3-→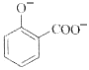 +2H2O+2CO2↑
+2H2O+2CO2↑
D. 用高锰酸钾标准溶液滴定草酸:2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示实验装置,下列说法不正确的是
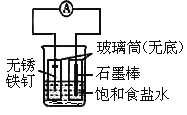
A. 装置为铁的吸氧腐蚀实验
B. 一段时间后,向插入石墨棒的玻璃筒内滴入石蕊试液,可观察到石墨附近的溶液变红
C. 一段时间后,向插入铁钉的玻璃筒内滴入NaOH溶液,即可观察到铁钉附近的溶液有沉淀出现
D. 若将装置中饱和食盐水换成稀硫酸,装置为析氢腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:Ti(s) +2Cl2(g) = TiCl4(l) △H = -804.2 kJ ·mol-1;
2Na(s) +Cl2(g) = 2NaCl(s) △H = -882.0 kJ ·mol-1
Na(s) = Na(l) △H =2.6 kJ ·mol-1
请写出用液态钠与四氯化钛置换出钛的热化学方程式__________________________。
(2)已知:向一个体积恒定为2L的密闭容器中充入4mol A、1mol B,发生如下反应:4A(g)+B(s) ![]() 3C(s)+4D(g)。该反应中各物质的摩尔质量(单位g·mol-1)都不一样,在一定条件下该反应2分钟达到平衡。
3C(s)+4D(g)。该反应中各物质的摩尔质量(单位g·mol-1)都不一样,在一定条件下该反应2分钟达到平衡。
①不能够说明该反应已达到平衡的是:________。
A.恒温下,容器内的压强不再变化
B.恒温下,容器内混合气体的密度不再变化
C.一定条件下,D的体积分数保持不变
D.一定条件下,单位时间内消耗4molA的同时生成1 mol B
②平衡后测得D的浓度为0.3mol·L-1,则从反应开始到平衡时,A的平均反应速率为________,B转化率为________。
(3)用活性炭还原法可以处理氮氧化物,有关反应为:2NO(g)+C(s) ![]() N2(g)+CO2(g);△H,向某密闭容器加入一定量的活性炭和NO,在t℃下反应,有关数据如图:
N2(g)+CO2(g);△H,向某密闭容器加入一定量的活性炭和NO,在t℃下反应,有关数据如图:
NO | N2 | CO2 | |
起始浓度/molL─1 | 0.10 | 0 | 0 |
平衡浓度/molL─1 | 0.04 | 0.03 | 0.03 |
①在t℃下,该反应的平衡常数为________(保留两位有效数字)。
②平衡后升高温度,再次达到平衡,测得容器中NO、N2、CO2的浓度之比为2:1:1,则该反应的
ΔH________0(填“>”、“<”或“=”),此时NO的转化率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用相同浓度的KOH溶液,分别滴定浓度均为0.1 mol·L1的三种酸(HA、HB和HD)溶液,滴定曲线如图所示,下列判断正确的是
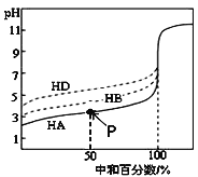
A. 当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(H+)+c(OH)
B. 滴定至P点时,溶液中:c(K+)> c(A)> c(HA)> c(H+)> c(OH)
C. 同浓度的KA、KB、KD三种盐溶液的pH大小关系:pH(KD)< pH(KB)< pH(KA)
D. 当三种酸都中和至中性时,消耗KOH溶液的体积的大小关系为:V(HA) > V(HB) > V(HD)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com