
已知HF、CH3COOH均为弱酸,酸性强弱顺序为HF>CH3COOH。下列说法不正确的是( )
A.浓度均为0.1mol·L-1的NaF、CH3COONa溶液相比较,CH3COONa溶液碱性较强
B.0.1m ol·L-1CH3COOH溶液,加水稀释过程中,所有离子浓度均减小
ol·L-1CH3COOH溶液,加水稀释过程中,所有离子浓度均减小
C.NaF溶液中含有Na+、F-、H+、OH-、H2O、HF六种微粒
D.NaF溶液中加入少量NaOH固体,溶液中c(F-)变大
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案科目:高中化学 来源:2017届四川省绵阳市高三第二次诊断性考试化学试卷(解析版) 题型:选择题
常温下,用0.1000 mol/L的盐酸滴定20.00 mL未知浓度的Na2CO3溶液,溶液的pH与所加盐酸的体积关系如图所示。下列有关叙述正确的是
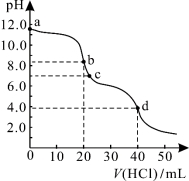
A.a点溶液呈碱性的原因用离子方程式表示为:CO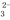 +2H2O
+2H2O H2CO3+2OH-
H2CO3+2OH-
B.c点处的溶液中c(Na+)-c(Cl-)=c(HCO )+2c(CO
)+2c(CO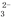 )
)
C.滴定过程中使用甲基橙作为指示剂比酚酞更准确
D.d点处溶液中水电离出的c(H+)大于b点处
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省惠州市高二上学期高二质量检测化学试卷(解析版) 题型:实验题
活性氧化锌是一种多功能性的新型材料.某小组以粗氧化锌(含铁、铜的氧化物)为原料模拟工业生产活性氧化锌,步骤如下:
已知各相关氢氧化物沉淀pH范围如下表所示:
Zn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀pH | 5.4 | 7.0 | 2.3 | 4.7 |
完全沉淀pH | 8.0 | 9.0 | 4.1 | 6.7 |
步骤II中,在酸性溶液中加入KMnO4的作用是将Fe2+ 氧化成Fe3+,离子方程式为 ;
(2)用ZnO调节pH,以除去含铁杂质。检验沉淀是否完全的实验操作是 ;调节pH的适宜范围是 。
(3)步骤III中加入Zn粉的作用是① ,②进一步调节溶液PH值。
(4)用如下方法测定所得活性氧化锌的纯度(假设杂质不参与反应):
取1.000g活性氧化锌,用15.00mL 1.00mol/L硫酸溶液完全溶解,滴入几滴指示剂,再用0.50mol/L的标准氢氧化钠溶液滴定剩余硫酸,到达终点时消耗氢氧化钠溶液12.00mL,通过计算可以得到活性氧化锌的纯度,由表中Zn(OH)2PH变化可知,滴入的最理想的指示剂是 (填“酚酞”、“甲基橙”或“石蕊试剂”)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省惠州市高二上学期高二质量检测化学试卷(解析版) 题型:选择题
一定条件下,在某密闭容器中,有下列可逆反应:2X(g)+Y(g) 2Z(g);△H<0,下列有关该反应的说法中正确的是
A.该反应的正反应为吸热反应
B.当各物质浓度不再变化时,反应达到平衡状态
C.若温度不变,平衡后把容器的体积增大一倍,平衡将不移动
D.若升高温度,平衡向正反应的方向移动
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省定西市通渭县高二上学期期末化学试卷(解析版) 题型:填空题
现有反应aA(g)+bB(g) pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应是________热反应,且a+b________p(填“>”“<”或“=”)。
(2)减压时,A的质量分数________(填“增 大”“减小”或“不变”,下同),正反应速率________,逆反应速率________。
大”“减小”或“不变”,下同),正反应速率________,逆反应速率________。
(3)若加入B(体积不变),则A的转化率________,B的转化率________。
(4)若升高温度,则平衡时,B、C的浓度之比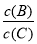 将________。
将________。
(5)若加入催化剂,平衡时气体混合物的总物质的量________。
(6)若B是有色物质,A、C均为无色物质,则加入A(体积不变)时混合物的颜色________,加入C(体积不变)时混合物的颜色________,而维持容器内气体的压强不变,充入氖气时,混合物的颜色_______(填“变浅”“变深”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2016-2017黑龙江牡丹江第一高级中学高一上期末化学卷(解析版) 题型:实验题
I.喷泉是一种常见的自然现象,其产生的原因是存在压强差。

(1)实验室制取氨气的化学方程式____ __。
①用图1装置进行喷泉实验,上部烧瓶已充满干燥氨气,引发水上喷的操作是___________。
②如果只提供如图2的装置, (“能”或“不能”)实现喷泉实验
(2)利用图3装置,在锥形瓶中,分别加入足量的下列物质,反应后可能产生喷泉的是________。
A.Cu与稀盐酸 B.NaHCO3溶液与NaOH溶液
C.CaCO3与稀H2SO4D.NH4HCO3与稀盐酸
(3)在图4锥形瓶中加入酒精,瓶外放一水槽,水槽中加入冷水后,再加入足量的下列物质,结果也产生了喷泉。水槽中加入的物质可以是________。
A.浓硫酸 B.食盐
C.硝酸钾 D.硫酸铜

(4)从产生喷泉的原理分析,图 是减小上部烧瓶内的压强。图 是增大下部锥形瓶内气体的压强。人造喷泉及火山爆发的原理与上述装置图________原理相似。(均填序号)
II.某研究性学习小组,为了探究过氧化钠的强氧化性,设计了如图的实验装置。

实验步骤及现象如下:
①检查装置气密性后,装入药品并连接仪器。
②缓慢通入一定量的N2后,将装置D连接好(导管末端未伸入集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸,反应剧烈,产生黄绿色气体。
③一段时间后,将导管末端伸入集气瓶中收集气体。装置D中收集到能使带火星的木条复燃的无色气体。
④反应结束后,关闭分液漏斗的活塞,再通入一定量的N2,至装置中气体无色。
回答下列问题:
(1)装置B中的湿润的红色纸条褪色,证明A中反应有 (填化学式)生成。若B中改放湿润的淀粉KI试纸,仅凭试纸变蓝的现象不能证明上述结论,请用离子方程式说明原因 。
(2)装置C的作用是 。
(3)甲同学认为O2是Na2O2被盐酸中的HCl还原所得。乙同学认为此结论不正确,他可能的理由为
① ;② 。
(4)实验证明,Na2O2能与干燥的HCl反应,完成并配平该化学方程式。
Na2O2 + HCl ----- Cl2 + NaCl +
该反应 (填“能”或“不能”)用于实验室快速制取纯净的Cl2,理由是 (要求答出一个要点即可)。
查看答案和解析>>
科目:高中化学 来源:2016-2017黑龙江牡丹江第一高级中学高一上期末化学卷(解析版) 题型:选择题
在Na+的物质的量浓度为0.5mol•L-1的某澄清溶液中,还可能含有如下离子:K+、Mg2+、Ba2+、NO3-、CO32-、SO42-。取100mL该溶液进行如下实验(气体体积在标准状况下测定):
I.向该溶液中加入足量稀盐酸,在标准状况下放出0.56L气体(不考虑气体溶解);
II.向I中所得的滤液中滴加足量BaCl2溶液产生白色沉淀2.33g;
下列说法正确的是( )
A.一定不存在的离子是Mg2+、Ba2+,不能确定是否含有K+、NO3-
B.一定存在的离子是CO32-、SO42-,CO32-的物质的量浓度为0.25mol•L-1,SO42-的物质的量浓度为0.1mol•L-1
C.一定存在的离子是CO32-、SO42-、K+,其中K+浓度≥0.2mol•L-1
D.一定存在的离子是CO32-、SO42-、K+,其中K+浓度为0.2mol•L-1
查看答案和解析>>
科目:高中化学 来源:2016-2017黑龙江牡丹江第一高级中学高一上期末化学卷(解析版) 题型:选择题
下列实验中,对应的现象以及结论都正确的是( )
选项 | 实验 | 现象 | 结论 |
A | 将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液 | 有气体生成,溶液呈红色 | 稀硝酸将Fe氧化为Fe3+ |
B | 将铜粉加入1.0mol/LFe2(SO4)3溶液中,k.Com] | 溶液变蓝,有黑色固体出现 | 金属铁比铜活泼 |
C | 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热 | 熔化后的液态铝滴落下来 | 金属铝的熔点较低 |
D | 在相同条件下,分别加热Na2CO3固体和NaHCO3固体 | NaHCO3固体分解,产生气体使澄清石灰水变浑浊,Na2CO3固体并没有分解 | Na2CO3固体的稳定性比NaHCO3好 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年贵州省高二上期末化学卷(解析版) 题型:填空题
甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列反应合成甲醇:CO (g)+2H2(g) CH3OH(g);该反应的平衡常数表达式为 。
CH3OH(g);该反应的平衡常数表达式为 。
(2)某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应,5min时达到平衡,测得 c(CH3OH)=0.8 mol·L-1 ,则H2的化学反应速率为 ,CO的转化率为___________。
,则H2的化学反应速率为 ,CO的转化率为___________。
(3)下列叙述中,能说明反应已达到化学平衡状态的是_______(填序号字母)。
A. 容器内CO、H2、CH3OH的浓度之比为1∶2∶1
B.v(CO) (正):v(H2) (逆) =1:2
C.容器内压强保持不变
D.混合气体的平 均分子量保持不变
均分子量保持不变
(4)已知在常温常压下:
①2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH1=-1452.8 kJ·mol-
②2CO(g)+O2(g)===2CO2(g) ΔH2=-566.0 kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: .
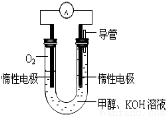
(5)某同学依据甲醇燃烧的反应原理,设计如图所示的电池装置:工作一段时间后,测得溶液的pH将 填“升高”、“降低”、“不变”),该燃料电池负极反应的离子方程式为: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com